
Histoire de la théorie cinétique moléculaire, postulats et exemples

La théorie cinétique moléculaire C'est celui qui cherche à expliquer les observations expérimentales des gaz d'un point de vue microscopique. C'est-à-dire qu'il essaie d'associer la nature et le comportement des particules gazeuses, aux caractéristiques physiques du gaz en tant que fluide; expliquer le macroscopique du microscopique.
Les gaz ont toujours intéressé les scientifiques en raison de leurs propriétés. Ils occupent tout le volume du récipient dans lequel ils se trouvent, pouvant être complètement comprimés sans que leur contenu s'oppose à la moindre résistance; et si la température augmente, le récipient commence à se dilater, et peut même se fissurer.
Bon nombre de ces propriétés et comportements sont résumés dans les lois des gaz parfaits. Cependant, ils considèrent le gaz dans son ensemble et non comme une collection de millions de particules dispersées dans l'espace; En outre, il ne fournit pas, sur la base des données de pression, de volume et de température, d'autres informations sur la façon dont ces particules se déplacent..
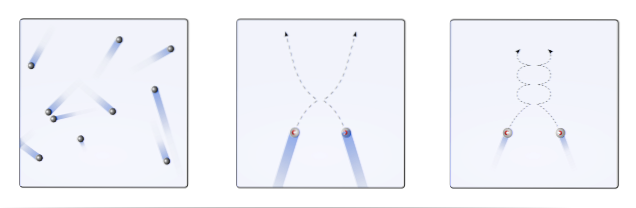
C'est ainsi que la théorie de la cinétique moléculaire (TCM), propose de les visualiser sous forme de sphères mobiles (image du haut). Ces sphères se heurtent les unes aux autres et aux parois de manière arbitraire, et maintiennent une trajectoire linéaire. Cependant, lorsque la température diminue et que la pression augmente, la trajectoire des sphères se courbe..
Un gaz, selon TCM, devrait se comporter comme les sphères dans la première image de l'image. Mais, en se refroidissant et en augmentant la pression sur eux, leur comportement est loin d'être idéal. Ce sont alors de vrais gaz, proches de subir une liquéfaction et passent ainsi en phase liquide.
Dans ces conditions, les interactions entre les sphères deviennent plus importantes, au point que leurs vitesses ralentissent momentanément. Plus ils sont proches de la liquéfaction, plus leurs trajectoires deviennent courbes (encadré à droite), et moins leurs collisions sont énergiques.
Index des articles
- 1 Histoire
- 1.1 Daniel Bernoulli
- 1.2 Rudolf Clausius
- 1.3 James Clerk Maxwell et Ludwig Boltzmann
- 2 Postulats de la théorie cinétique moléculaire
- 2.1 Le volume des particules gazeuses est négligeable
- 2.2 Les forces d'attraction entre les particules sont nulles
- 2.3 Les particules gazeuses sont toujours en mouvement
- 2.4 Les collisions entre les particules et les parois du conteneur sont élastiques
- 2.5 L'énergie cinétique ne reste pas constante
- 2.6 L'énergie cinétique moyenne est égale à une température donnée pour tous les gaz
- 3 exemples
- 3.1 Loi de Boyle
- 3.2 Loi de Charles
- 3.3 Loi de Dalton
- 4 Références
Histoire
Daniel Bernoulli
L'idée de ces sphères, mieux appelées atomes, avait déjà été envisagée par le philosophe romain Lucrèce; pas pour les gaz, mais pour les objets solides et statiques. D'autre part, en 1738, Daniel Bernoulli appliqua la vision atomique aux gaz et aux liquides en les imaginant comme des sphères désordonnées se déplaçant dans toutes les directions..
Son travail, cependant, a violé les lois de la physique à l'époque; un corps ne pouvait pas bouger éternellement, il était donc impossible de penser qu'un ensemble d'atomes et de molécules se heurterait sans perdre leur énergie; c'est-à-dire que l'existence de collisions élastiques n'était pas possible.
Rudolf Clausius
Un siècle plus tard, d'autres auteurs ont renforcé le TCM avec un modèle où les particules gazeuses se déplaçaient dans une seule direction. Rudolf Clausius, cependant, a compilé ses résultats et mis en place un modèle TCM plus complet avec lequel il a cherché à expliquer les lois des gaz parfaits démontrées par Boyle, Charles, Dalton et Avogadro..
James Clerk Maxwell et Ludwig Boltzmann
En 1859, James Clerk Maxwell a déclaré que les particules gazeuses présentent une gamme de vitesses à une température donnée, et qu'un ensemble d'entre elles peut être considéré au moyen d'une vitesse moléculaire moyenne..
Puis, en 1871, Ludwig Boltzmann a relié les idées existantes à l'entropie, et comment le gaz a toujours tendance à occuper le plus d'espace possible de manière homogène et spontanée..
Postulats de la théorie cinétique moléculaire
Pour considérer le gaz à partir de ses particules, un modèle est nécessaire dans lequel certains postulats ou hypothèses sont remplis; postule que logiquement doit être capable de prédire et d'expliquer (aussi précisément que possible) les observations macroscopiques et expérimentales. Cela dit, les postulats de la MTC sont mentionnés et décrits.
Le volume des particules gazeuses est négligeable
Dans un récipient rempli de particules gazeuses, celles-ci se dispersent et s'éloignent les unes des autres dans tous les coins. Si un instant ils pouvaient tous être rassemblés en un point précis du conteneur, sans liquéfaction, on observerait qu'ils n'occupent qu'une partie négligeable du volume du conteneur..
Cela signifie que le conteneur, même s'il contient des millions de particules gazeuses, est en réalité plus vide que plein (rapport volume-vide bien inférieur à 1); par conséquent, si ses barrières le permettent, elle et le gaz à l'intérieur peuvent être brusquement comprimés; car en fin de compte les particules sont très petites, tout comme leur volume.
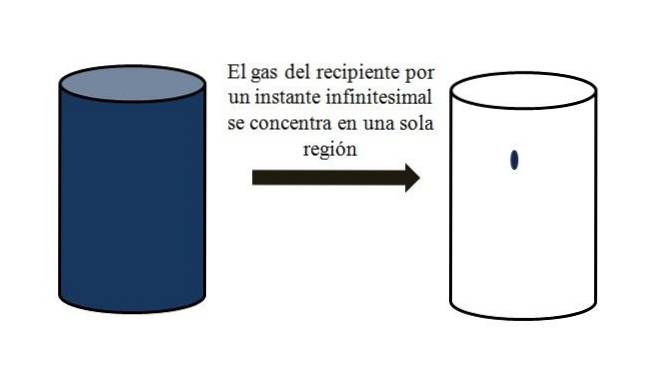
L'image du haut illustre avec précision ce qui précède, en utilisant un gaz de couleur bleuâtre.
Les forces d'attraction entre les particules sont nulles
Les particules gazeuses à l'intérieur du conteneur entrent en collision les unes avec les autres sans suffisamment de temps pour que leurs interactions gagnent en force; encore moins quand ce qui les entoure principalement est le vide moléculaire. Une conséquence immédiate de ceci est que leurs trajectoires linéaires leur permettent d'englober complètement le volume du conteneur..
Si tel n'était pas le cas, un récipient de forme «bizarre» et «labyrinthique» aurait des régions humides en raison de la condensation de gaz; au lieu de cela, les particules voyagent autour du conteneur en toute liberté, sans que la force de leurs interactions les arrête.
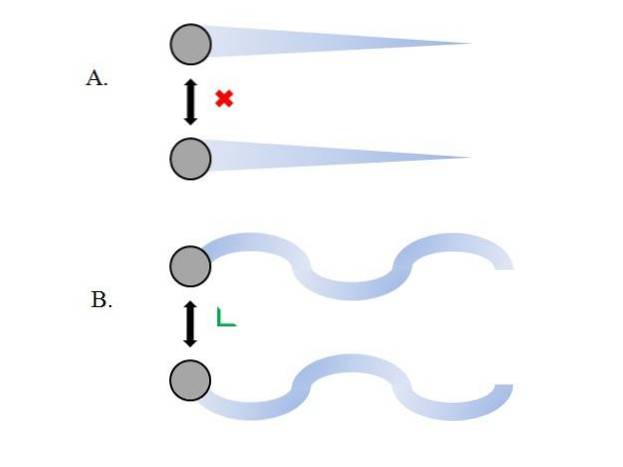
Les trajectoires linéaires de l'image supérieure (A.) démontrent ce postulat; tandis que si les trajectoires sont courbes (B.), cela montre qu'il y a des interactions qui ne peuvent être ignorées entre les particules.
Les particules gazeuses sont toujours en mouvement
A partir des deux premiers postulats, le fait que les particules de gaz ne s'arrêtent jamais de bouger converge également. Une fois flous dans le contenant, ils se heurtent entre eux et avec ses parois, avec une force et une vitesse directement proportionnelles à la température absolue; cette force est, la pression.
Si les particules gazeuses arrêtaient de bouger pendant un instant, des «langues de fumée» seraient vues à l'intérieur du récipient, émergeant de nulle part, avec suffisamment de temps pour se disposer dans le vide et donner des formes aléatoires..
Les collisions entre les particules et les parois du conteneur sont élastiques
Si seules les collisions élastiques entre les particules gazeuses et les parois du conteneur prédominent à l'intérieur du conteneur, la condensation du gaz ne se produira jamais (tant que les conditions physiques ne changent pas); ou ce qui revient à dire qu'ils ne se reposent jamais et se heurtent toujours.
En effet, dans les collisions élastiques, il n'y a pas de perte nette d'énergie cinétique; une particule entre en collision avec la paroi et rebondit à la même vitesse. Si une particule lors de la collision ralentit, l'autre accélère, sans produire de chaleur ou de son qui dissipe l'énergie cinétique de l'un ou l'autre.
L'énergie cinétique ne reste pas constante
Le mouvement des particules est aléatoire et chaotique, de sorte qu'elles n'ont pas toutes la même vitesse; comme cela se produit, par exemple, sur une autoroute ou dans une foule. Certains sont plus énergiques et voyagent plus vite, tandis que d'autres sont lents, attendant qu'une collision les accélère.
Pour décrire sa vitesse, il faut alors calculer une moyenne; et avec cela, l'énergie cinétique moyenne des particules ou molécules gazeuses est obtenue à son tour. L'énergie cinétique de toutes les particules étant en constante évolution, la moyenne permet un meilleur contrôle des données et peut être travaillée avec une plus grande fiabilité..
L'énergie cinétique moyenne est égale à une température donnée pour tous les gaz
Énergie cinétique moléculaire moyenne (ECmp) dans un récipient change avec la température. Plus la température est élevée, plus l'énergie sera élevée. Parce qu'il s'agit d'une moyenne, il peut y avoir des particules ou des gaz qui ont une énergie supérieure ou inférieure à cette valeur; certains plus rapides et d'autres plus lents, respectivement.
Mathématiquement, on peut montrer que ECmp cela dépend exclusivement de la température. Cela signifie que quel que soit le gaz, sa masse ou sa structure moléculaire, sa CEmp il sera le même à une température T et ne variera que s'il augmente ou diminue. De tous les postulats, c'est peut-être le plus pertinent..
Et qu'en est-il de la vitesse moléculaire moyenne? Contrairement à ECmp, la masse moléculaire influence la vitesse. Plus la particule ou la molécule gazeuse est lourde, il est naturel de s'attendre à ce qu'elle se déplace plus lentement..
Exemples
Voici quelques brefs exemples de la façon dont TCM a réussi à expliquer les lois des gaz parfaits. Bien que non abordés, d'autres phénomènes, tels que la diffusion et l'épanchement de gaz, peuvent également être expliqués avec TCM.
La loi de Boyle
Si le volume du récipient est comprimé à température constante, la distance que les particules gazeuses doivent parcourir pour entrer en collision avec les parois diminue; ce qui est égal à une augmentation de la fréquence de telles collisions, entraînant une pression plus élevée. Comme la température reste constante, ECmp c'est aussi constant.
Charles Law
Si vous augmentez T, ECmp augmentera. Les particules gazeuses se déplaceront plus rapidement et entreront en collision un plus grand nombre de fois avec les parois du récipient; donc la pression augmente.
Si les murs sont flexibles, capables de se dilater, leur surface deviendra plus grande et la pression chutera jusqu'à ce qu'elle devienne constante; et par conséquent, le volume augmentera également.
Loi de Dalton
Si plusieurs litres de gaz différents étaient ajoutés à un conteneur spacieux, provenant de conteneurs plus petits, sa pression interne totale serait égale à la somme des pressions partielles exercées par chaque type de gaz séparément..
Parce que? Parce que tous les gaz commencent à se heurter et à se disperser de manière homogène; les interactions entre eux sont nulles, et le vide prédomine dans le récipient (TCM postule), c'est donc comme si chaque gaz était seul, exerçant sa pression individuellement sans l'interférence des autres gaz.
Les références
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE, P 426-431.
- Fernandez Pablo. (2019). Théorie cinétique moléculaire. Vix. Récupéré de: vix.com
- Jones, Andrew Zimmerman. (7 février 2019). Théorie moléculaire cinétique des gaz. Récupéré de: thinkco.com
- Salle Nancy. (5 mai 2015). Théorie cinétique des gaz. Centre de recherche Glenn. Récupéré de: grc.nasa.gov
- Blaber M. & Lower S. (9 octobre 2018). Bases de la théorie moléculaire cinétique. Chimie LibreTexts. Récupéré de: chem.libretexts.org
- La théorie moléculaire cinétique. Récupéré de: chemed.chem.purdue.edu
- Wikipédia. (2019). Théorie cinétique des gaz. Récupéré de: en.wikipedia.org
- Toppr. (s.f.). Théorie moléculaire cinétique des gaz. Récupéré de: toppr.com



Personne n'a encore commenté ce post.