
Formule, propriétés et utilisations du thiosulfate de sodium (Na2S2O3)
le thiosulfate de sodium ou hyposulfite de sodium (NadeuxSdeuxOU ALORS3) C'est un sel inorganique important avec diverses utilisations médicales. Il est également disponible sous forme de sel pentahydraté (NadeuxSdeuxOU ALORS3.5HdeuxOU ALORS).
C'est un composé ionique formé par deux cations sodium (Na+) et l'anion thiosulfate chargé négativement (SdeuxOU ALORS3-), dans lequel l'atome de soufre central est lié à trois atomes d'oxygène et à un autre atome de soufre (d'où le préfixe oncle), par des liaisons simples et doubles à caractère de résonance. Le solide existe dans une structure cristalline monoclinique.
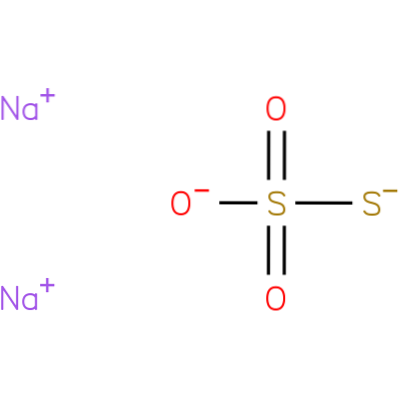
Le thiosulfate de sodium peut être préparé en chauffant du soufre avec une solution aqueuse de sulfite de sodium ou une solution aqueuse d'hydroxyde de sodium..
6NaOH + 4S → NadeuxSdeuxOU ALORS3 + 2NadeuxS + 3HdeuxOU ALORS
C'est un médicament qui figure sur la liste des médicaments essentiels de l'Organisation mondiale de la santé, les médicaments les plus efficaces et les plus sûrs nécessaires dans un système de santé (Sodium Thiosulfate Formula, S.F.).
Index des articles
- 1 Propriétés physiques et chimiques
- 2 Réactivité et dangers
- 3 utilisations
- 3.1 Médecine
- 3.2 Iodométrie
- 3.3 Déchloration de l'eau
- 3.4 Extraction d'or
- 4 Références
Proprietes physiques et chimiques
Le thiosulfate de sodium a un poids moléculaire de 158,11 g / mol pour sa forme anhydre et de 248,18 g / mol pour la forme pentahydratée. De plus, il a une densité de 1667 g / ml (National Center for Biotechnology Information., 2017).
Le thiosulfate de sodium sont des cristaux monocliniques incolores sans arôme caractéristique. Ledit solide est efflorescent, ce qui signifie qu'il peut être réduit en poussière par lui-même par perte d'eau de cristallisation lorsqu'il est exposé à l'air. Son apparence est illustrée à la figure 2.

Le composé a un point de fusion de 48 ° C pour la forme pentahydratée et à partir de 100 ° C il commence à se décomposer. Puis undeuxSdeuxOU ALORS3 Il est très soluble dans l'eau, pouvant dissoudre 70 grammes pour 100 millilitres de solvant. Le composé est pratiquement insoluble dans l'éthanol (Royal Society of Chemistry, 2015).
Le thiosulfate de sodium est un sel neutre qui se dissocie facilement dans l'eau pour donner des ions sodium et thiosulfate. N / AdeuxSdeuxOU ALORS3 C'est un solide stable dans des conditions normales, mais se décompose en chauffant pour donner du sulfate de sodium et du polysulfure de sodium:
4NadeuxSdeuxOU ALORS3 → 3NadeuxSW4 + N / AdeuxS5
Il se décompose également lorsqu'il est traité avec des acides dilués pour donner du soufre et du dioxyde de soufre (appelé réaction d'horloge):
N / AdeuxSdeuxOU ALORS3 + 2HCl → 2NaCl + S + SOdeux + HdeuxOU ALORS
Réagit stoechiométriquement (en quantités équimolaires) avec des solutions aqueuses d'iode, ce qui le rend largement utilisé dans les laboratoires pour les titrages à base d'iode.
Réactivité et dangers

Le thiosulfate de sodium n'est pas une matière toxique et est utilisé à des fins médicales. Cependant, une fois décomposé, il produit des fumées toxiques d'oxyde de soufre, qui peuvent provoquer une irritation des yeux, de la peau et des muqueuses..
Le composé peut irriter les yeux, la peau et les voies respiratoires. La substance est toxique pour les poumons et les muqueuses. Une exposition répétée ou prolongée à la substance peut provoquer des lésions de ces organes..
Si le composé entre en contact avec les yeux, les lentilles de contact doivent être vérifiées et retirées. Les yeux doivent être rincés immédiatement à grande eau pendant au moins 15 minutes à l'eau froide.
En cas de contact avec la peau, la zone affectée doit être immédiatement rincée à grande eau pendant au moins 15 minutes, tout en retirant les vêtements et les chaussures contaminés. Couvrir la peau irritée d'un émollient. Lavez les vêtements et les chaussures avant de les réutiliser. Si le contact est sévère, laver avec un savon désinfectant et recouvrir la peau contaminée d'une crème antibactérienne.
En cas d'inhalation, la victime doit être déplacée dans un endroit frais. S'il ne respire pas, la respiration artificielle est pratiquée. Si la respiration est difficile, donnez de l'oxygène.
Si le composé est ingéré, le vomissement ne doit pas être provoqué sauf indication contraire par le personnel médical. Desserrez les vêtements serrés comme un col de chemise, une ceinture ou une cravate.
Dans tous les cas, une attention médicale immédiate doit être obtenue. (Fiche signalétique Thiosulfate de sodium anhydre, 2013).
Applications
Médicament
Le thiosulfate de sodium peut être utilisé pour diminuer certains des effets secondaires du cisplatine (un médicament anticancéreux). Il est utilisé dans la gestion des extravasations pendant la chimiothérapie. Le thiosulfate de sodium empêche l'alkylation et la destruction des tissus en fournissant un substrat pour les agents alkylants qui ont envahi les tissus sous-cutanés.
Il est également utilisé avec un autre médicament dans le traitement d'urgence de l'intoxication au cyanure (U.S. National Library of Medicine, S.F.).
Dans ce traitement, du nitrite de sodium est injecté par voie intraveineuse pour produire de l'hémoglobine qui se combine avec l'ion cyanure, la convertissant temporairement en forme de cyanméthoglobine. Par la suite, le thiosulfate de sodium est injecté.
Le thiosulfate sert de substrat à l'enzyme rhodanase, qui catalyse la conversion du cyanure en thiocyanate beaucoup moins toxique, qui est excrété dans l'urine (HSDB: SODIUM THIOSULFATE, 2003).
Le thiosulfate de sodium est également utilisé comme traitement de la calciphylaxie chez les personnes sous hémodialyse atteintes d'insuffisance rénale terminale. Il y a apparemment un phénomène mal compris, par lequel cela provoque une acidose métabolique sévère chez certains patients..
Iodométrie
Le thiosulfate de sodium réagit stoechiométriquement avec l'iode pour donner de l'iodure selon la réaction:
2NadeuxSdeuxOU ALORS3 + I2 → S4OU ALORS62− + 2I-
Cette propriété permet au composé d'être utilisé comme titrant dans la détermination de l'iode..
Cette utilisation particulière peut être établie pour mesurer la teneur en oxygène de l'eau grâce à une longue série de réactions dans le test de Winkler pour l'oxygène dissous..
Il est également utilisé dans l'estimation volumétrique des concentrations de certains composés en solution (peroxyde d'hydrogène, par exemple) et dans l'estimation de la teneur en chlore dans l'eau de Javel en poudre et l'eau du commerce..
Déchloration de l'eau
El tiosulfato de sodio se utiliza para desclorar el agua, incluyendo la reducción de los niveles de cloro para su uso en acuarios y piscinas y spas y dentro de las plantas de tratamiento de agua para tratar el agua de lavado posterior establecida antes de su liberación en Les rivières.
La réaction de réduction est analogue à la réaction de réduction de l'iode, le thiosulfate réduit l'hypochlorite (ingrédient actif dans l'eau de Javel) et, ce faisant, s'oxyde en sulfate. La réaction complète est:
4NaClO + NadeuxSdeuxOU ALORS3 + 2NaOH → 4NaCl + 2NadeuxSW4 + HdeuxOU ALORS
Extraction d'or
Le thiosulfate de sodium est un composant utilisé comme agent de lessivage alternatif au cyanure pour l'extraction de l'or. Cependant, il forme un complexe soluble fort avec les ions or (I), [Au (SdeuxOU ALORS3)deux]3-.
L'avantage de cette approche est que le thiosulfate est essentiellement non toxique et que les types de minéraux réfractaires à la cyanuration de l'or peuvent être lixiviés par le thiosulfate (M.G Aylmore, 2001).
Les références
- EMBL-EBI. (2016, 1 juin). thiosulfate de sodium. Récupéré de ebi.ac.uk: ebi.ac.uk.
- HSDB: THIOSULFATE DE SODIUM. (2003, 3 mai). Récupéré de toxnet: toxnet.nlm.nih.gov.
- G Aylmore, D. M. (2001). Revue de lixiviation au thiosulfate de l'or-A. Minerals Engineering Volume 14, numéro 2, 135-174. sciencedirect.com.
- Fiche signalétique Thiosulfate de sodium anhydre. (2013, 21 mai). Récupéré de sciencelab.com.
- Centre national d'information sur la biotechnologie… (18 mars 2017). Base de données des composés PubChem; CID = 24477. Récupéré de pubchem.ncbi.nlm.nih.gov.
- Société royale de chimie. (2015). Thiosulfate de sodium. Récupéré de chemspider.com.
- Formule de thiosulfate de sodium. (S.F.). Récupéré de softschools: softschools.com.
- S. Bibliothèque nationale de médecine. (S.F.). Thiosulfate de sodium (dans une veine). Récupéré de ncbi.nlm.nih.gov.



Personne n'a encore commenté ce post.