
Caractéristiques de l'atome de carbone, structure, hybridation

le atome de carbone c'est peut-être le plus important et le plus emblématique de tous les éléments, car grâce à lui, l'existence de la vie est possible. Il renferme en soi non seulement quelques électrons, ou un noyau avec des protons et des neutrons, mais aussi de la poussière d'étoile, qui finit par s'incorporer et forme des êtres vivants.
De même, les atomes de carbone se trouvent dans la croûte terrestre, bien que pas en abondance comparable aux éléments métalliques tels que le fer, les carbonates, le dioxyde de carbone, l'huile, les diamants, les glucides, etc., ils font partie de ses manifestations physiques et chimiques..
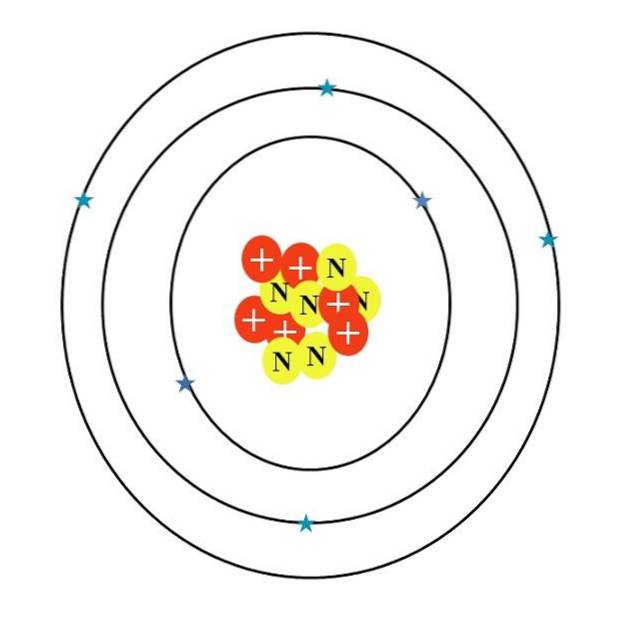
Mais à quoi ressemble l'atome de carbone? Un premier croquis inexact est celui vu dans l'image ci-dessus, dont les caractéristiques sont décrites dans la section suivante.
Les atomes de carbone traversent l'atmosphère, les mers, le sous-sol, les plantes et toutes les espèces animales. Sa grande diversité chimique est due à la grande stabilité de ses liaisons et à la manière dont elles sont disposées dans l'espace. Ainsi, d'une part, il existe du graphite doux et lubrifiant; et de l'autre, le diamant, dont la dureté dépasse celle de nombreux matériaux.
Si l'atome de carbone n'avait pas les qualités qui le caractérisent, la chimie organique n'existerait pas complètement. Certains visionnaires y voient les nouveaux matériaux du futur, à travers la conception et la fonctionnalisation de leurs structures allotropes (nanotubes de carbone, graphène, fullerènes, etc.).
Index des articles
- 1 Caractéristiques de l'atome de carbone
- 2 Structure
- 3 Hybridation
- 3.1 sp3
- 3.2 sp2 et sp
- 4 Classement
- 4.1 Primaire
- 4.2 Secondaire
- 4.3 Tertiaire
- 4.4 Quaternaire
- 5 utilisations
- 5.1 Unité de masse atomique
- 5.2 Cycle et vie du carbone
- 5.3 Spectroscopie RMN 13C
- 6 Références
Caractéristiques de l'atome de carbone
L'atome de carbone est symbolisé par la lettre C. Son numéro atomique Z est 6, donc il a six protons (cercles rouges avec le symbole "+" dans le noyau). De plus, il possède six neutrons (cercles jaunes avec la lettre "N") et enfin six électrons (étoiles bleues).
La somme des masses de ses particules atomiques donne une valeur moyenne de 12,0107 u. Cependant, l'atome de l'image correspond à l'isotope du carbone 12 (12C), qui se compose de d. D'autres isotopes, tels que 13C et 14C, moins abondant, ne varie que dans le nombre de neutrons.
Ainsi, si ces isotopes ont été dessinés, le 13C aurait un cercle jaune supplémentaire, et le 14C, deux de plus. Cela signifie logiquement qu'ils sont des atomes de carbone plus lourds..
En plus de cela, quelles autres caractéristiques peut-on mentionner à cet égard? Il est tétravalent, c'est-à-dire qu'il peut former quatre liaisons covalentes. Il est situé dans le groupe 14 (IVA) du tableau périodique, plus précisément dans le bloc p.
C'est aussi un atome très polyvalent, capable de se lier à presque tous les éléments du tableau périodique; notamment avec lui-même, formant des macromolécules et des polymères linéaires, ramifiés et laminaires.
Structure
Quelle est la structure d'un atome de carbone? Pour répondre à cette question, il faut d'abord se rendre dans sa configuration électronique: 1sdeux2 sdeux2 Pdeux ou [He] 2sdeux2 Pdeux.
Par conséquent, il y a trois orbitales: les 1deux, les 2deux et le 2pdeux, chacun avec deux électrons. Cela peut également être vu dans l'image ci-dessus: trois anneaux avec deux électrons (étoiles bleues) chacun (ne confondez pas les anneaux avec des orbites: ce sont des orbitales).
Notez, cependant, que deux des étoiles ont une nuance de bleu plus foncée que les quatre autres. Parce que? Parce que les deux premiers correspondent à la couche intérieure 1sdeux ou [He], qui ne participe pas directement à la formation de liaisons chimiques; tandis que les électrons de la couche externe, 2s et 2p, font.
Les orbitales s et p n'ont pas la même forme, donc l'atome illustré ne correspond pas à la réalité; en plus de la grande disproportion de la distance entre les électrons et le noyau, qui devrait être des centaines de fois plus grande.
Par conséquent, la structure de l'atome de carbone se compose de trois orbitales où les électrons «fondent» en nuages électroniques flous. Et entre le noyau et ces électrons il y a une distance qui révèle l'immense "vide" à l'intérieur de l'atome..
Hybridation
Il a été mentionné précédemment que l'atome de carbone est tétravalent. Selon sa configuration électronique, ses électrons 2s sont appariés et les électrons 2p non appariés:
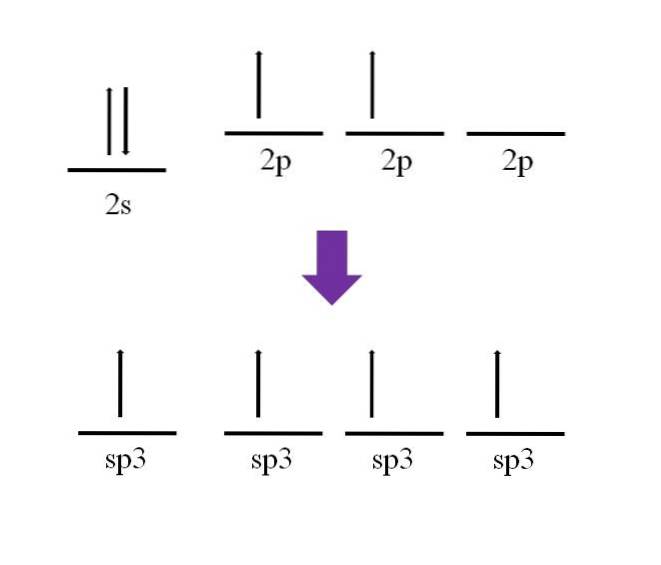
Une orbitale p est disponible, qui est vide et remplie d'un électron supplémentaire sur l'atome d'azote (2p3).
Selon la définition de la liaison covalente, il faut que chaque atome apporte un électron pour sa formation; cependant, on peut voir que dans le état de base de l'atome de carbone, il n'a que deux électrons non appariés (un dans chaque orbitale 2p). Cela signifie que dans cet état, il s'agit d'un atome divalent, et par conséquent, il ne forme que deux liaisons (-C-).
Alors, comment est-il possible pour l'atome de carbone de former quatre liaisons? Pour ce faire, vous devez promouvoir un électron de l'orbitale 2s à l'orbitale 2p d'énergie supérieure. Ceci fait, les quatre orbitales résultantes sont dégénérer; en d'autres termes, ils ont la même énergie ou stabilité (notez qu'ils sont alignés).
Ce processus est connu sous le nom d'hybridation, et grâce à lui, l'atome de carbone a maintenant quatre orbitales sp3 avec un électron chacun pour former quatre liaisons. Cela est dû à sa caractéristique d'être tétravalent.
sp3
Lorsque l'atome de carbone a une hybridation sp3, oriente ses quatre orbitales hybrides vers les sommets d'un tétraèdre, qui est sa géométrie électronique.
Ainsi, on peut identifier un carbone sp3 car il ne forme que quatre liaisons simples, comme dans la molécule de méthane (CH4). Et autour d'elle un environnement tétraédrique peut être observé.
Le chevauchement des orbitales SP3 il est si efficace et stable que la simple liaison C-C a une enthalpie de 345,6 kJ / mol. Cela explique pourquoi il existe des structures carbonatées infinies et un nombre incommensurable de composés organiques. En plus de cela, les atomes de carbone peuvent former d'autres types de liaisons.
spdeux et sp
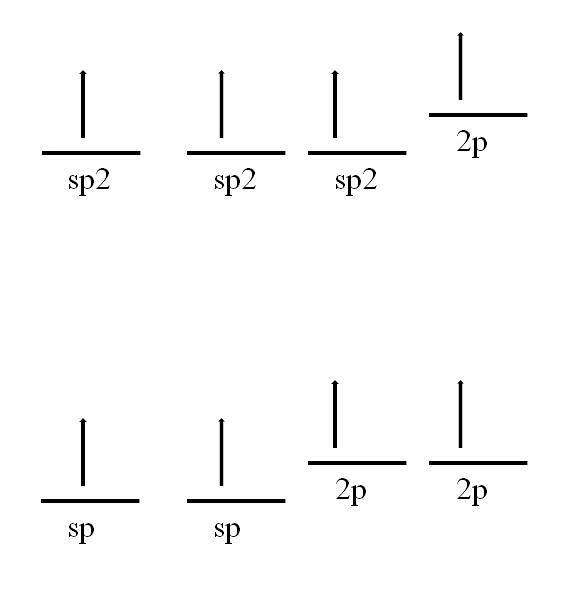
L'atome de carbone est également capable d'adopter d'autres hybridations, ce qui lui permettra de former une double voire triple liaison.
Dans l'hybridation spdeux, comme on le voit dans l'image, il y a trois orbitales spdeux dégénérée et une orbitale 2p reste inchangée ou «pure». Avec les trois orbitales SPdeux Distants de 120 °, le carbone forme trois liaisons covalentes dessinant une géométrie électronique plane trigonale; tandis qu'avec l'orbitale 2p, perpendiculaire aux trois autres, elle forme une liaison π: -C = C-.
Dans le cas de l'hybridation sp, il y a deux orbitales sp distantes de 180 °, de telle sorte qu'elles dessinent une géométrie électronique linéaire. Cette fois, ils ont deux orbitales 2p pures, perpendiculaires l'une à l'autre, qui permettent au carbone de former des triples liaisons ou deux doubles liaisons: -C≡C- ou ·· C = C = C ·· (le carbone central a une hybridation sp ).
Notez que toujours (généralement) si les liaisons autour du carbone sont ajoutées, on constatera que le nombre est égal à quatre. Ces informations sont essentielles pour dessiner des structures de Lewis ou des structures moléculaires. Un atome de carbone formant cinq liaisons (= C≡C) est théoriquement et expérimentalement inadmissible.
Classification
Comment les atomes de carbone sont-ils classés? Plus qu'une classification par caractéristiques internes, cela dépend en fait de l'environnement moléculaire. Autrement dit, dans une molécule, ses atomes de carbone peuvent être classés selon ce qui suit.
Primaire
Un carbone primaire est celui qui n'est lié qu'à un seul autre carbone. Par exemple, la molécule d'éthane, CH3-CH3 Il se compose de deux carbones primaires liés. Cela signale la fin ou le début d'une chaîne carbonée.
Secondaire
C'est celui qui est lié à deux carbones. Ainsi, pour la molécule de propane, CH3-CHdeux-CH3, l'atome de carbone moyen est secondaire (le groupe méthylène, -CHdeux-).
Tertiaire
Les carbones tertiaires diffèrent des autres car des branches de la chaîne principale en émergent. Par exemple, le 2-méthylbutane (également appelé isopentane), CH3-CH(CH3) -CHdeux-CH3 a un carbone tertiaire mis en évidence en gras.
Quaternaire
Et enfin, les carbones quaternaires, comme leur nom l'indique, sont liés à quatre autres atomes de carbone. La molécule de néopentane, C(CH3)4 possède un atome de carbone quaternaire.
Applications
Unité de masse atomique
La masse atomique moyenne du 12C est utilisé comme mesure standard pour calculer les masses des autres éléments. Ainsi, l'hydrogène pèse un douzième de cet isotope du carbone, qui sert à définir ce que l'on appelle unité de masse atomique u.
Ainsi, les autres masses atomiques peuvent être comparées à celle du 12C et le 1H. Par exemple, le magnésium (24Mg) pèse environ deux fois le poids d'un atome de carbone et 24 fois plus qu'un atome d'hydrogène.
Cycle et vie du carbone
Les plantes absorbent le COdeux dans le processus de photosynthèse pour libérer de l'oxygène dans l'atmosphère et agir comme des poumons végétaux. Quand ils meurent, ils se transforment en charbon de bois qui, après avoir brûlé, libère à nouveau du COdeux. Une partie retourne aux plantes, mais une autre finit dans les fonds marins, nourrissant de nombreux micro-organismes.
Lorsque les micro-organismes meurent, le solide restant dans ses sédiments de décomposition biologique, et après des millions d'années, il se transforme en ce que l'on appelle le pétrole..
Lorsque l'humanité utilise cette huile comme source d'énergie alternative à la combustion du charbon, elle contribue à la libération de plus de COdeux (et autres gaz indésirables).
D'un autre côté, la vie utilise des atomes de carbone du plus profond de l'intérieur. Cela est dû à la stabilité de ses liaisons, qui lui permet de former des chaînes et des structures moléculaires qui composent des macromolécules aussi importantes que l'ADN..
Spectroscopie RMN 13C
le 13C, bien qu'il soit dans une proportion beaucoup plus petite que celle de la 12C, son abondance est suffisante pour élucider les structures moléculaires par spectroscopie de résonance magnétique nucléaire au carbone 13.
Grâce à cette technique d'analyse, il est possible de déterminer quels atomes entourent le 13C et à quels groupes fonctionnels ils appartiennent. Ainsi, le squelette carboné de tout composé organique peut être déterminé..
Les références
- Graham Solomons T.W., Craig B. Fryhle. Chimie organique. Amines. (10e édition.) Wiley Plus.
- Blake D. (4 mai 2018). Quatre caractéristiques du carbone. Récupéré de: scaimer.com
- Société royale de chimie. (2018). Charbon. Tiré de: rsc.org
- Comprendre l'évolution. (s.f.). Voyage d'un atome de carbone. Récupéré de: evolution.berkeley.edu
- Encyclopædia Britannica. (14 mars 2018). Charbon. Récupéré de: britannica.com
- Pappas S. (29 septembre 2017). Faits sur le carbone. Récupéré de: livescience.com


Personne n'a encore commenté ce post.