
Topoisomérases caractéristiques, fonctions, types et inhibiteurs
le topoisomérases Ce sont des types d'enzymes isomérases qui modifient la topologie de l'acide désoxyribonucléique (ADN), générant à la fois son déroulement et son enroulement et son surenroulement.
Ces enzymes ont un rôle spécifique dans le soulagement du stress de torsion dans l'ADN, de sorte que des processus importants tels que la réplication, la transcription de l'ADN en acide ribonucléique messager (ARNm) et la recombinaison de l'ADN peuvent se produire..
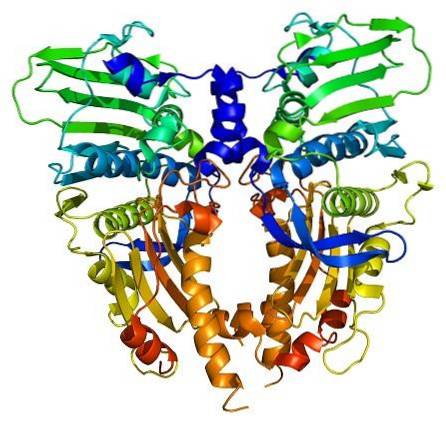
Les enzymes topoisomérases sont présentes à la fois dans les cellules eucaryotes et procaryotes. Son existence a été prédite par les scientifiques Watson et Crick, lors de l'évaluation des limites que la structure de l'ADN présente pour permettre l'accès à ses informations (stockées dans sa séquence nucléotidique).
Pour comprendre les fonctions des topoisomérases, l'ADN doit être considéré comme ayant une structure à double hélice stable, avec ses brins enroulés les uns sur les autres..
Ces chaînes linéaires sont constituées de 2-désoxyribose lié par des liaisons phosphodiester 5'-3 ', et de bases azotées à l'intérieur, comme les échelons d'un escalier en colimaçon..
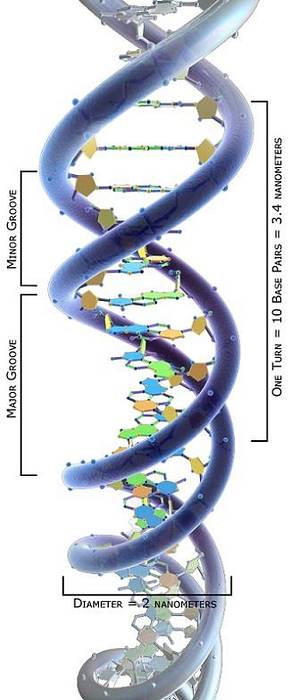
L'étude topologique des molécules d'ADN a montré qu'elles peuvent prendre différentes conformations en fonction de leur contrainte de torsion: d'un état relâché à différents états de bobinage permettant leur compactage..
Les molécules d'ADN avec différentes conformations sont appelées topoisomères. Ainsi, nous pouvons conclure que les topoisomérases I et II peuvent augmenter ou diminuer la contrainte de torsion des molécules d'ADN, formant leurs différents topoisomères..
Parmi les topoisomères d'ADN possibles, la conformation la plus courante est le supercoil, qui est très compact. Cependant, la double hélice d'ADN doit également être déroulée par des topoisomérases au cours de divers processus moléculaires..
Index des articles
- 1 Fonctionnalités
- 1.1 Mécanisme général d'action
- 1.2 Topoisomérases et cycle cellulaire
- 2 fonctions
- 2.1 Stockage compact du matériel génétique
- 2.2 Accès à l'information génétique
- 2.3 Régulation de l'expression génique
- 2.4 Particularités de la topoisomérase II
- 3 types de topoisomérases
- 3.1 -Topoisomérases de type I
- 3.2 -Topoisomérases de type II
- 3.3 - Topoisomérases humaines
- 4 inhibiteurs de la topoisomérase
- 4.1 -Topoisomérases comme cible d'attaque chimique
- 4.2 -Types d'inhibition
- 4.3 - Médicaments inhibiteurs de la topoisomérase
- 5 Références
Caractéristiques
Mécanisme général d'action
Certaines topoisomérases ne peuvent détendre que les super-enroulements négatifs d'ADN, ou les deux super-enroulements d'ADN: positifs et négatifs.
Si l'ADN circulaire double brin est déroulé sur son axe longitudinal et qu'un virage à gauche (dans le sens des aiguilles d'une montre) se produit, on dit qu'il est surenroulé négativement. Si le tour est dans le sens des aiguilles d'une montre (dans le sens inverse des aiguilles d'une montre), il est trop enroulé.

Fondamentalement, les topoisomérases peuvent:
-Faciliter le passage d'un brin d'ADN à travers une coupe dans le brin opposé (topoisomérase de type I).
-Faciliter le passage d'une double hélice complète à travers un clivage lui-même, ou à travers un clivage en une double hélice différente (topoisomérase de type II).
En résumé, les topoisomérases agissent par le clivage des liaisons phosphodiester, dans un ou les deux brins qui composent l'ADN. Puis ils modifient l'état d'enroulement des brins d'une double hélice (topoisomérase I) ou de deux doubles hélices (topoisomérase II), pour enfin nouer ou nouer à nouveau les extrémités clivées.
Topoisomérases et cycle cellulaire
Bien que la topoisomérase I soit une enzyme qui présente une plus grande activité pendant la phase S (synthèse d'ADN), elle n'est pas considérée comme dépendante d'une phase du cycle cellulaire.
Alors que l'activité de la topoisomérase II est la plus active pendant la phase logarithmique de la croissance cellulaire et dans les cellules de tumeurs à croissance rapide.
Caractéristiques
L'altération des gènes codant pour les topoisomérases est mortelle pour les cellules, ce qui témoigne de l'importance de ces enzymes. Parmi les processus auxquels participent les topoisomérases, on trouve:
Stockage compact du matériel génétique
Les topoisomérases facilitent le stockage d'informations génétiques de manière compacte, du fait qu'elles génèrent l'enroulement et le superenroulement de l'ADN, permettant de trouver une grande quantité d'informations dans un volume relativement petit.
Accès à l'information génétique
Sans les topoisomérases et leurs caractéristiques uniques, l'accès aux informations stockées dans l'ADN serait impossible. Cela est dû au fait que les topoisomérases libèrent périodiquement la contrainte de torsion qui est générée dans la double hélice d'ADN, lors de son déroulement, dans les processus de réplication, de transcription et de recombinaison..
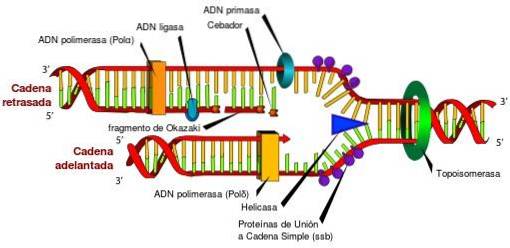
Si la contrainte de torsion générée au cours de ces processus n'est pas libérée, une expression génique défectueuse pourrait se produire, l'interruption de l'ADN circulaire ou du chromosome, entraînant même la mort cellulaire..
Régulation de l'expression génique
Les changements conformationnels (dans la structure tridimensionnelle) de la molécule d'ADN exposent des régions spécifiques à l'extérieur, qui peuvent interagir avec les protéines de liaison à l'ADN. Ces protéines ont une fonction régulatrice de l'expression génique (positive ou négative).
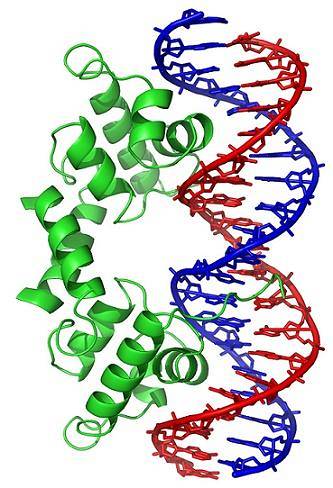
Ainsi, l'état d'enroulement de l'ADN, généré par l'action des topoisomérases, affecte la régulation de l'expression génique.
Particularités de la topoisomérase II
La topoisomérase II est nécessaire pour l'assemblage des chromatides, la condensation et la décondensation des chromosomes et la ségrégation des molécules d'ADN filles pendant la mitose..
Cette enzyme est également une protéine structurelle et l'un des principaux constituants de la matrice du noyau cellulaire pendant l'interphase..
Types de topoisomérases
Il existe deux principaux types de topoisomérases selon qu'elles sont capables de cliver un ou deux brins d'ADN.
-Topoisomérases de type I
Monomère
Les topoisomérases de type I sont des monomères qui atténuent les superenroulements négatifs et positifs, qui sont produits par le mouvement en épingle à cheveux pendant la transcription, et pendant les processus de réplication et de recombinaison des gènes..
Les topoisomérases de type I peuvent être subdivisées en type 1A et type 1B. Ces derniers sont ceux que l'on trouve chez l'homme et sont responsables de la relaxation de l'ADN surenroulé.
Tyrosine dans son site actif
La topoisomérase 1B (Top1B) est constituée de 765 acides aminés répartis en 4 domaines spécifiques. L'un de ces domaines a une zone hautement conservée contenant le site actif de la tyrosine (Tyr7233). Toutes les topoisomérases présentent dans leur site actif une tyrosine ayant un rôle fondamental dans l'ensemble du processus catalytique.
Mécanisme d'action
La tyrosine du site actif forme une liaison covalente avec l'extrémité 3'-phosphate du brin d'ADN, la coupant et la maintenant attachée à l'enzyme, tout en faisant passer un autre brin d'ADN à travers le clivage.
Le passage de l'autre brin d'ADN à travers le brin divisé est réalisé grâce à une transformation conformationnelle de l'enzyme, qui produit l'ouverture de la double hélice d'ADN..
Ensuite, la topoisomérase I revient à sa conformation initiale et lie à nouveau les extrémités clivées. Cela se produit par un processus inverse de la dégradation de la chaîne d'ADN, au niveau du site catalytique de l'enzyme. Enfin, la topoisomérase libère le brin d'ADN.
Le taux de ligature de l'ADN est supérieur au taux d'excision, assurant ainsi la stabilité de la molécule et l'intégrité du génome..
En résumé, la topoisomérase de type I catalyse:
- Le clivage d'un brin.
- Le passage de l'autre brin à travers le clivage.
- Ligature des extrémités clivées.
-Topoisomérases de type II
Dimérique
Les topoisomérases de type II sont des enzymes dimères, qui clivent les deux brins d'ADN, relaxant ainsi les super-enroulements générés lors de la transcription et d'autres processus cellulaires.
Mg dépendant++ et ATP
Ces enzymes ont besoin de magnésium (Mg++) et ont également besoin de l'énergie provenant de la rupture de la liaison ATP triphosphate, dont ils profitent grâce à une ATPase.
Deux sites actifs avec la tyrosine
Les topoisomérases humaines II sont très similaires à celles de la levure (Saccharomyces cerevisiae), qui se compose de deux monomères (sous-fragments A et B). Chaque monomère a un domaine ATPase et, dans un sous-fragment, le site actif tyrosine 782, auquel l'ADN peut se lier. Ainsi, deux brins d'ADN peuvent se lier à la topoisomérase II..
Mécanisme d'action
Le mécanisme d'action de la topoisomérase II est le même que celui décrit pour la topoisomérase I, étant donné que deux brins d'ADN sont séparés et pas un seul..
Au site actif de la topoisomérase II, un fragment de double hélice d'ADN, appelé «fragment G». Ce fragment est excisé et maintenu ensemble au site actif par des liaisons covalentes..
Ensuite, l'enzyme laisse passer un autre fragment d'ADN, appelé «fragment T», à travers le fragment clivé «G», grâce à un changement conformationnel de l'enzyme, qui dépend de l'hydrolyse de l'ATP.
La topoisomérase II lie les deux extrémités du «fragment G» et retrouve finalement son état initial, libérant le fragment «G». L'ADN détend alors la contrainte de torsion, permettant aux processus de réplication et de transcription de se produire..
-Topoisomérases humaines
Le génome humain comporte cinq topoisomérases: top1, top3α, top3β (de type I); et top2α, top2β (de type II). Les topoisomérases humaines les plus pertinentes sont top1 (topoisomérase de type IB) et 2α (topoisomérase de type II).
Inhibiteurs de la topoisomérase
-Topoisomérases comme cible d'attaque chimique
Parce que les processus catalysés par les topoisomérases sont nécessaires à la survie des cellules, ces enzymes sont une bonne cible d'attaque pour affecter les cellules malignes. Pour cette raison, les topoisomérases sont considérées comme importantes dans le traitement de nombreuses maladies humaines..
Les médicaments qui interagissent avec les topoisomérases sont actuellement largement étudiés en tant que substances chimiothérapeutiques contre les cellules cancéreuses (dans différents organes du corps) et les microorganismes pathogènes..
-Types d'inhibition
Les médicaments qui inhibent l'activité de la topoisomérase peuvent:
- Pris en sandwich dans l'ADN.
- Affecte l'enzyme topoisomérase.
- Intercaler dans une molécule proche du site actif de l'enzyme tandis que le complexe ADN-topoisomérase est stabilisé.
La stabilisation du complexe transitoire formé par la liaison de l'ADN à la tyrosine du site catalytique de l'enzyme, empêche la liaison des fragments clivés, ce qui peut entraîner la mort cellulaire.
-Médicaments inhibiteurs de la topoisomérase
Les composés qui inhibent les topoisomérases comprennent les suivants.
Antibiotiques antitumoraux
Les antibiotiques sont utilisés contre le cancer, car ils empêchent la croissance des cellules tumorales, généralement en interférant avec leur ADN. Ceux-ci sont souvent appelés antibiotiques antinéoplasiques (cancéreux). L'actinomycine D, par exemple, affecte la topoisomérase II et est utilisée dans les tumeurs de Wilms chez les enfants et les rhabdomyosarcomes.
Anthracyclines
Les anthracyclines sont, parmi les antibiotiques, l'un des médicaments anticancéreux les plus efficaces et avec le spectre le plus large. Ils sont utilisés pour traiter le cancer du poumon, des ovaires, de l'utérus, de l'estomac, de la vessie, du sein, de la leucémie et des lymphomes. Il est connu pour affecter la topoisomérase II par intercalation dans l'ADN.
La première anthracycline isolée d'une actinobactérie (Streptomyces peucetius) était la daunorubicine. Plus tard, la doxorubicine a été synthétisée en laboratoire, et actuellement l'épirubicine et l'idarubicine sont également utilisées.
Anthraquinones
Les anthraquinones ou anthracènediones sont des composés dérivés de l'anthracène, similaires aux anthracyclines, qui affectent l'activité de la topoisomérase II par intercalation dans l'ADN. Ils sont utilisés pour le cancer du sein métastatique, le lymphome non hodgkinien (LNH) et la leucémie..
Ces médicaments ont été trouvés dans les pigments de certains insectes, plantes (frangula, séné, rhubarbe), lichens et champignons; ainsi que la hoelite, qui est un minéral naturel. Selon votre dose, ils peuvent être cancérigènes.
Parmi ces composés, nous avons la mitoxantrone et son analogue, la losoxantrone. Ceux-ci empêchent la prolifération de cellules tumorales malignes, se liant à l'ADN de manière irréversible.
Épidophyllotoxines
Les podophyllotoxines, telles que les épidophyllotoxines (VP-16) et le téniposide (VM-26), forment un complexe avec la topoisomérase II. Ils sont utilisés contre le cancer du poumon, des testicules, la leucémie, les lymphomes, le cancer de l'ovaire, le carcinome du sein et les tumeurs intracrâniennes malignes, entre autres. Ils sont isolés des plantes Podophyllum notatum Oui P. peltatum.
Analogues de camptothécine
Les campothécines sont des composés qui inhibent la topoisomérase I, y compris l'irinotécan, le topotécan et le diflomotécan..
Ces composés ont été utilisés contre le cancer du côlon, du poumon et du sein et sont obtenus naturellement à partir de l'écorce et des feuilles de l'espèce arboricole. Camptotheca acuminata des corniches chinoises et du Tibet.
Inhibition naturelle
Des altérations structurelles des topoisomérases I et II peuvent également se produire de manière totalement naturelle. Cela peut se produire lors de certains événements qui affectent votre processus catalytique.
Ces altérations comprennent la formation de dimères de pyrimidine, les mésappariements des bases azotées et d'autres événements causés par le stress oxydatif..
Les références
- Anderson, H. et Roberge, M. (1992). ADN topoisomérase II: Un examen de son implication dans la structure chromosomique, la réplication de l'ADN, la transcription et la mitose Rapports internationaux de biologie cellulaire, 16 (8): 717-724. doi: 10.1016 / s0309-1651 (05) 80016-5
- Chhatriwala, H., Jafri, N., et Salgia, R. (2006). Un examen de l'inhibition de la topoisomérase dans le cancer du poumon. Biologie et thérapie du cancer, 5 (12): 1600-1607. doi: 10.4161 / cbt.5.12.3546
- Ho, Y.-P., Au-Yeung, S. C. F., et To, K. K. W. (2003). Agents anticancéreux à base de platine: stratégies de conception innovantes et perspectives biologiques. Medicinal Research Reviews, 23 (5): 633-655. doi: 10.1002 / med.10038
- Li, T.-K. et Liu, L. F. (2001). Mort des cellules tumorales induite par les médicaments ciblant la topoisomérase. Revue annuelle de pharmacologie et de toxicologie, 41 (1): 53-77. doi: 10.1146 / annurev.pharmtox.41.1.53
- Liu, L. F. (1994). Topoisomérases à ADN: médicaments ciblant les topoisomérases. Presse académique. pp 307
- Osheroff, N. et Bjornsti, M. (2001). ADN topoisomérase. Enzymologie et médicaments. Vol. II. Humana Press. pp 329.
- Rothenberg, M. L. (1997). Inhibiteurs de la topoisomérase I: examen et mise à jour. Annales d'oncologie, 8 (9), 837-855. doi: 10.1023 / a: 1008270717294
- Ryan B. (14 décembre 2009). Topoisomérase 1 et 2. [Fichier vidéo]. Récupéré de youtube.com



Personne n'a encore commenté ce post.