
Structure, propriétés, utilisations, impact du tripolyphosphate de sodium (Na5P3O10)
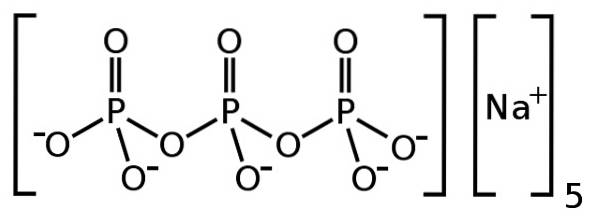
le tripolyphosphate de sodium est un composé inorganique formé de cinq ions sodium Na+ et un ion tripolyphosphate P3OU ALORSdix5-. Sa formule chimique est Na5P3OU ALORSdix. L'ion tripolyphosphate contient trois unités de phosphate liées ensemble et est ce qu'on appelle un phosphate condensé.
L'anion tripolyphosphate P3OU ALORSdix5- a la capacité de piéger les ions tels que le calcium Cadeux+ et magnésium Mgdeux+, Par conséquent, le tripolyphosphate de sodium est utilisé comme aide dans les détergents afin qu'ils fonctionnent mieux dans certains types d'eau..
Le tripolyphosphate de sodium est également utilisé comme source de phosphore dans l'alimentation des animaux au pâturage et dans le traitement de certaines affections d'autres types d'animaux. Il est également utilisé pour épaissir et donner de la texture à certains aliments transformés tels que les crèmes, les puddings et les fromages..
Dans l'industrie agricole, il est utilisé dans les engrais granulaires pour les empêcher de coller ensemble et de rester en vrac..
Bien qu'il y ait eu des discussions sur l'impact environnemental du tripolyphosphate de sodium ajouté aux détergents, on estime actuellement qu'il ne contribue pas de manière appréciable à endommager l'environnement, du moins par le biais des détergents..
Index des articles
- 1 Structure chimique
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Point de fusion
- 3.4 Densité
- 3.5 Solubilité
- 3,6 pH
- 3.7 Propriétés chimiques
- 3.8 Autres propriétés
- 4 Obtention
- 5 utilisations
- 5.1 Dans les détergents
- 5.2 À usage vétérinaire
- 5.3 En médecine
- 5.4 Dans l'industrie alimentaire
- 5.5 Autres utilisations
- 6 Impact environnemental
- 7 risques
- 8 Références
Structure chimique
Le tripolyphosphate de sodium est l'un des phosphates dits condensés car il se compose de plusieurs unités de phosphate liées entre elles. Dans ce cas, l'ion tripolyphosphate est un phosphate condensé linéaire car il a une structure en forme de chaîne linéaire, avec des liaisons phosphore-oxygène-phosphore (P-O-P).
Nomenclature
- Tripolyphosphate de sodium
- Triphosphate de sodium
- Triphosphate pentasodique
- STPP (acronyme de l'anglais TriPolyPhosphate de sodium)
Propriétés
État physique
Solide cristallin incolore à blanc.
Poids moléculaire
367,86 g / mol.
Point de fusion
622 ° C.
Densité
2,52 g / cm3
Solubilité
Soluble dans l'eau: 20 g / 100 mL à 25 ° C et 86,5 g / 100 mL à 100 ° C.
pH
Une solution à 1% de tripolyphosphate de sodium a un pH de 9,7 à 9,8.
Propriétés chimiques
C'est un agent séquestrant d'ions, c'est-à-dire qu'il peut piéger les ions et rester attachés à eux. Forme des complexes avec de nombreux métaux.
Si une solution de tripolyphosphate de sodium est chauffée pendant une longue période, elle a tendance à se convertir en orthophosphate de sodium Na.3PO4.
Autres propriétés
Il est légèrement hygroscopique. Il forme des hydrates stables, c'est-à-dire des composés auxquels sont attachées des molécules d'eau (sans avoir réagi avec elles) de formule Na5P3OU ALORSdix.nHdeuxOu où n peut être compris entre 1 et 6.
Selon certaines sources, une quantité de 20 mg de tripolyphosphate de sodium dans un litre d'eau n'affecte pas l'odeur, le goût ou le pH de ladite eau..
Obtention
Le tripolyphosphate de sodium est préparé en déshydratant des orthophosphates (tels que le phosphate monosodique NaHdeuxPO4 et phosphate disodique NadeuxHPO4) à des températures très élevées (300-1200 ° C):
NaHdeuxPO4 + 2 NadeuxHPO4 → Na5P3OU ALORSdix + 2 heuresdeuxOU ALORS
Il peut également être obtenu par calcination contrôlée (moyen de chauffage à très haute température) de l'orthophosphate de sodium Na.3PO4 avec du carbonate de sodium NadeuxCO3 et acide phosphorique H3PO4.
Applications
Dans les détergents
Le tripolyphosphate de sodium a la propriété de former des composés avec certains ions, en les retenant. Il possède également des propriétés dispersantes pour les particules de saleté et les maintient en suspension..
Pour cette raison, il est largement utilisé dans les formulations détergentes pour piéger et immobiliser les ions calcium Ca.deux+ et magnésium Mgdeux+ eau (dite eau dure) et pour maintenir la saleté en suspension dans l'eau.
Les ions mentionnés interfèrent avec l'action de nettoyage. En les piégeant, le tripolyphosphate empêche ces ions de précipiter avec l'agent de nettoyage ou de coller la saleté sur le tissu, empêchant la tache de s'en détacher..
On dit dans ce cas que le tripolyphosphate de sodium "adoucit" l'eau. Pour cette raison, il est utilisé dans les détergents à lessive et les détergents pour lave-vaisselle automatiques..
Puisqu'il forme des hydrates stables, les détergents qui l'ont dans leur formulation peuvent être séchés instantanément par pulvérisation (spray très fin) formant des poudres sèches..

Pour usage vétérinaire
Le tripolyphosphate de sodium est utilisé comme complément dans les solutions liquides comme source de phosphore pour le bétail.

Il est également utilisé pour prévenir les calculs rénaux chez les chats, pour lesquels il est administré par voie orale à ces animaux. Cependant, une attention particulière doit être portée à la posologie car elle peut provoquer de la diarrhée..

En médecine
Le tripolyphosphate de sodium a été utilisé dans la préparation de nanoparticules pour le transport et l'administration appropriés de médicaments de chimiothérapie anticancéreuse. Il a également été utilisé dans les nanoparticules pour traiter les infections fongiques des poumons..
Dans l'industrie alimentaire
Utilisé dans les produits laitiers tels que les puddings, la crème fouettée, la crème sure et le fromage.

Dans d'autres aliments, il est utilisé comme séquestrant d'ions, pour donner de la texture, comme épaississant et comme conservateur.
Autres utilisations
- En tant que stabilisateur de peroxyde
- Dans les fluides de forage de puits de pétrole, il agit comme émulsifiant et dispersant pour contrôler la viscosité de la boue.
- En agriculture, il est utilisé comme agent anti-agglomérant pour certains engrais ou produits agricoles, cela signifie qu'il les empêche de coller ensemble et que l'engrais peut être facilement distribué. Il est également utilisé dans les formules de pesticides appliquées aux cultures en croissance.

Impact environnemental
L'utilisation de produits phosphatés a été identifiée comme l'un des contributeurs à l'eutrophisation de l'eau sur la planète.
L'eutrophisation est la croissance exagérée et accélérée des algues et des espèces de plantes aquatiques qui conduit à une forte diminution de l'oxygène disponible dans l'eau, conduisant à la destruction de l'écosystème affecté (mort de la plupart des espèces animales).

Une controverse a éclaté dans les années 80 selon laquelle l'utilisation de tripolyphosphate de sodium dans les détergents contribuait à l'eutrophisation.
Aujourd'hui, on sait que limiter l'utilisation de détergents avec du tripolyphosphate de sodium contribuerait très peu à éliminer l'eutrophisation, car les phosphates proviennent en plus grande quantité d'autres sources agricoles et industrielles..
En fait, certains pays considèrent le tripolyphosphate de sodium comme un composant écologique des détergents et encouragent son utilisation..
Des risques
Le tripolyphosphate de sodium est un irritant pour la peau et les yeux. Le contact avec les yeux peut provoquer des lésions oculaires. Un contact prolongé avec la peau peut provoquer une dermatite.
S'il est ingéré en grande quantité, il peut provoquer des nausées, des vomissements et de la diarrhée, générant également une réduction importante de l'ion calcium dans le sang. Chez les animaux, il a provoqué une diminution du calcium dans les os.
Il est considéré comme un composé sûr tant que les normes de fabrication du produit dans lequel il est utilisé sont respectées..
Les références
- Liu, Y. et Chen, J. (2014). Cycle du phosphore. Module de référence sur les systèmes terrestres et les sciences de l'environnement. Encyclopédie de l'écologie (deuxième édition). Vol.4, 2014, p. 181-191. Récupéré de sciencedirect.com
- NOUS. Bibliothèque nationale de médecine. (2019). Tripolyphosphate de sodium. Centre national d'information sur la biotechnologie. Récupéré de pubchem.ncbi.nlm.nih.gov.
- Mukherjee, B. et coll. (2017). Administration pulmonaire de nanotransporteurs de médicaments biodégradables pour un traitement plus efficace des infections fongiques des poumons: informations basées sur des résultats récents. Dans les systèmes multifonctionnels pour l'administration combinée, la détection biologique et le diagnostic. Récupéré de sciencedirect.com.
- Kirk-Othmer. (1991). Encyclopédie de la technologie chimique. 4e New York, John Wiley et fils.
- Burckett St. Laurent, J. et coll. (2007). Nettoyage de linge de textiles. In Handbook for Cleaning / Decontamination of Surfaces. Récupéré de sciencedirect.com.
- Budavari, S. (éditeur). (mille neuf cent quatre vingt seize). L'indice Merck. NJ: Merck et Co., Inc.
- Salahuddin, N. et Galal, A. (2017). Amélioration de l'administration des médicaments de chimiothérapie par des outils de nanoprécision In Nanostructures for Cancer Therapy. Récupéré de sciencedirect.com.



Personne n'a encore commenté ce post.