
Structure de l'iodure de potassium (KI), propriétés, obtention, utilisations, risques

le Iodure de potassium est un composé inorganique formé par un ion potassium (K+) et un ion iodure (I-). Sa formule chimique est KI. C'est un solide cristallin blanc, de nature ionique et très soluble dans l'eau..
Le KI permet d'effectuer diverses réactions et analyses chimiques et est utilisé pour mesurer la quantité d'ozone dans l'atmosphère. Également utilisé dans les équipements d'analyse infrarouge (IR).

L'iodure de potassium est ajouté au sel de table commun pour prévenir une carence en iode chez les humains, car cela peut être un problème de santé grave.
Il est utilisé comme expectorant car il aide le mucus à s'écouler facilement des voies respiratoires vers l'extérieur. Il est également utilisé pour traiter certaines infections fongiques et est utilisé dans certains cosmétiques.
Il est utilisé par les médecins vétérinaires pour soigner les animaux souffrant de problèmes similaires à ceux des humains, tels que la toux et les infections cutanées. Il est même ajouté en très petites quantités à l'alimentation animale.
Index des articles
- 1 Structure
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Point de fusion
- 3.4 Point d'ébullition
- 3.5 Densité
- 3.6 Solubilité
- PH 3,7
- 3.8 Propriétés chimiques
- 3.9 Autres propriétés
- 4 Obtention
- 5 utilisations
- 5.1 Dans le traitement de l'hyperthyroïdie
- 5.2 Dans d'autres applications médicales
- 5.3 Dans les applications vétérinaires
- 5.4 Protection de la glande thyroïde en cas d'urgence radioactive
- 5.5 Dans les mesures de l'ozone dans l'atmosphère
- 5.6 Dans diverses utilisations
- 6 risques
- 7 Références
Structure
L'iodure de potassium est un composé ionique formé par le cation potassium K+ et l'anion iodure I-, par conséquent, entre les deux, la liaison est ionique. L'état d'oxydation du potassium est +1 et la valence de l'iode est -1.
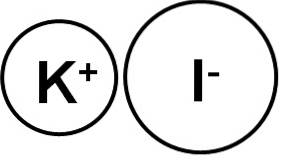
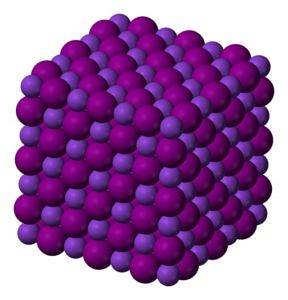
Les cristaux d'iodure de potassium KI sont cubiques.
Nomenclature
- Iodure de potassium
- Iodure de potassium
Propriétés
État physique
Solide cristallin incolore à blanc. Cristaux cubiques.
Poids moléculaire
166,003 g / mol
Point de fusion
681 ºC
Point d'ébullition
1323 ºC
Densité
3,13 g / cm3
Solubilité
Très soluble dans l'eau: 149 g / 100 g d'eau à 25 ° C. Légèrement soluble dans l'éthanol et l'éther.
pH
Ses solutions aqueuses sont neutres ou alcalines, avec un pH compris entre 7 et 9.
Propriétés chimiques
Légèrement hygroscopique dans l'air humide.
Il est stable à l'air sec. La lumière et l'humidité accélèrent sa décomposition et sa couleur vire au jaune en raison de la libération de petites quantités d'iode (Ideux) et les iodates (IO3-).
Les solutions aqueuses de KI jaunissent également avec le temps, mais un peu d'alcali peut empêcher cela.
Ces solutions dissolvent l'iode (Ideux) donnant KI3:
je- + jedeux → je3-
Autres propriétés
Il a un goût fortement amer et salin. Ce n'est pas inflammable.
Obtention
L'iodure de potassium peut être obtenu en chauffant de l'iode (Ideux) dans une solution concentrée d'hydroxyde de potassium (KOH):
3 jedeux + 6 KOH → 5 KI + KIO3 + HdeuxOU ALORS
La solution d'iodate et d'iodure résultante est chauffée pour éliminer l'eau, réduite à siccité, du charbon de bois est ajouté et chauffé à haute température. Le charbon prend l'oxygène de l'iodate et s'oxyde en dioxyde de carbone, réduisant ainsi l'iodate en iodure:
2 KIO3 + C → 2 KI + 3 COdeux
L'iodure de potassium obtenu peut être recristallisé pour purification. Autrement dit, il se dissout à nouveau dans l'eau et est amené à cristalliser à nouveau..
Applications
Dans le traitement de l'hyperthyroïdie
L'iodure de potassium sert de traitement supplémentaire avec d'autres agents antithyroïdiens pour traiter l'hyperthyroïdie.
L'hyperthyroïdie est une maladie qui fait que la glande thyroïde produit trop d'hormones thyroïdiennes, avec une thyroïde hypertrophiée, une diminution du poids, un rythme cardiaque rapide et de l'irritabilité, entre autres symptômes..
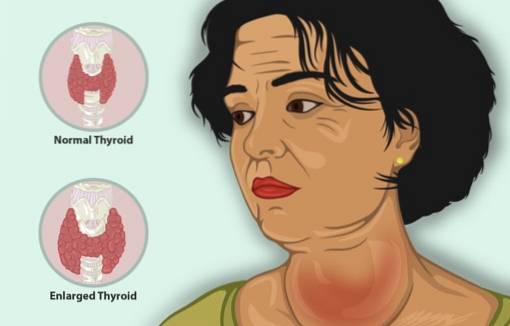
Chez les patients souffrant d'hyperthyroïdie, le KI réduit rapidement les symptômes car il inhibe la libération de l'hormone thyroïdienne.
Ses effets sur la thyroïde sont: diminution du nombre de vaisseaux sanguins dans la glande, raffermissement de ses tissus et réduction de la taille de ses cellules.
Pour cette raison, il est appliqué en traitement préopératoire pour induire l'involution ou la diminution de la taille de la thyroïde avant une thyroïdectomie (ablation de la thyroïde) car cela facilite cette opération..
Dans d'autres applications médicales
L'iodure de potassium a des propriétés expectorantes car il augmente la sécrétion des fluides respiratoires, entraînant une diminution de la viscosité du mucus..

Il est utilisé pour traiter l'érythème noueux, qui est un gonflement douloureux des jambes dans lequel se forment des nodules rouges et une augmentation de la température..
C'est un agent antifongique. Il permet de traiter la sporotrichose qui est une infection cutanée causée par un champignon. Cette maladie touche les personnes qui travaillent avec les plantes et le sol, comme les agriculteurs et les jardiniers..
Il est également utilisé dans le traitement de la carence en iode ou pour l'éviter et est donc ajouté au sel de table ou au sel comestible (chlorure de sodium NaCl) comme source d'iode et parfois dans l'eau potable..
Dans les applications vétérinaires
L'iodure de potassium est administré aux animaux comme antitussif, pour augmenter et liquéfier les fluides des voies respiratoires, pour la toux bronchique chronique, ainsi que dans les cas de rhumatisme et comme anti-inflammatoire..
Il est également utilisé pour les mycoses (infections fongiques) des animaux, pour réduire les démangeaisons et pour les intoxications chroniques au plomb ou au mercure.
En protégeant la glande thyroïde en cas d'urgence radioactive
L'iodure de potassium a des propriétés protectrices de la thyroïde dans le cas où la personne a été exposée à un rayonnement nucléaire.
Le KI inonde la thyroïde d'iode non radioactif bloquant ainsi l'absorption de molécules radioactives et l'absorption d'iode radioactif, protégeant la glande thyroïde du cancer que les radiations peuvent provoquer..
Dans les mesures de l'ozone dans l'atmosphère
Gaz ozone (O3) peuvent être mesurées dans l'atmosphère à l'aide de cellules électrolytiques appelées ozonesondes, portées par des ballons radiosondes.
Ces cellules électrolytiques contiennent une solution d'iodure de potassium KI. Les cellules sont initialement en équilibre chimique et électrique.
Lorsqu'un échantillon d'air d'ozone (O3) pénètre dans l'une des cellules, l'équilibre est rompu car la réaction suivante se produit:
2 KI + O3 + HdeuxO → jedeux + OU ALORSdeux + 2 KOH
Cette réaction produit un courant électrique qui circule entre les cellules..
La quantité de courant électrique produit est transmise en continu par ondes radio à une station au sol. De cette manière, le profil d'ozone du sol à la hauteur de la balle est obtenu..

Dans diverses utilisations
L'iodure de potassium permet également:
- Élimination des radicaux libres tels que le radical hydroxyle OH.
- La fabrication d'émulsions photographiques, pour précipiter l'argent.
- Améliorer l'alimentation animale en étant ajouté en micro-quantités.
- Désodoriser le fumier de bétail.
- Transmettre la lumière du spectre infrarouge dans un équipement d'analyse IR.
- Effectuer certaines réactions chimiques et analyses dans les laboratoires de chimie.
- Utilisez-le dans les produits d'hygiène personnelle.
- Effectuer une analyse de la contamination environnementale.
Des risques
Certaines personnes sensibles aux iodures doivent le prendre avec prudence car il peut provoquer de l'iodisme ou une intoxication chronique à l'iode, par exemple celles atteintes d'une maladie thyroïdienne auto-immune..
Les personnes atteintes de tuberculose ou de bronchite aiguë doivent également faire attention.
KI peut provoquer un ramollissement des glandes salivaires, il peut brûler la bouche ou la gorge, une augmentation inhabituelle de la salivation, des douleurs dentaires et une inflammation des gencives et un goût métallique, entre autres symptômes..
Il peut également irriter les yeux et ouvrir des plaies sur la peau..
Les références
- NOUS. Bibliothèque nationale de médecine. (2019). Iodure de potassium. Récupéré de pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyclopédie de la technologie chimique. Quatrième édition. John Wiley et fils.
- Dean, J.A. (éditeur). (1973). Manuel de chimie de Lange. Onzième édition. Compagnie du livre McGraw-Hill.
- Valkovic, V. (2019). Décontamination après exposition aux rayonnements. Parties du corps les plus sensibles. Dans Radioactivité dans l'environnement (deuxième édition). Récupéré de sciencedirect.com.
- Smit, H.G.J. (2015). Chimie de l'atmosphère-Observations pour la chimie (in situ). In Encyclopedia of Atmospheric Sciences (deuxième édition). Récupéré de sciencedirect.com.
- Muralikrishna, I.V. et Manickam, V. (2017). Méthodes d'analyse pour la surveillance de la pollution de l'environnement. Dans la gestion de l'environnement. Récupéré de sciencedirect.com.
- Wallace, J.M. et Hobbs, P.V. (2006). Chimie atmosphérique 1. En science atmosphérique (deuxième édition). Récupéré de sciencedirect.com.



Personne n'a encore commenté ce post.