
Structure, propriétés et utilisations du trioxyde d'arsenic (As2O3)
le trioxyde d'arsenic est un composé inorganique dont la formule chimique est AsdeuxOU ALORS3. L'arsenic à l'état métallique se transforme rapidement en cet oxyde, qui est un poison très toxique pouvant avoir des manifestations aiguës et chroniques..
Comme l'arsenic et l'oxygène sont des éléments du bloc p, avec une différence d'électronégativité relativement faible, on s'attend à ce que AsdeuxOU ALORS3 est composé de nature covalente; c'est-à-dire que les liaisons As-O prédominent dans son solide, sur les interactions électrostatiques entre les ions As3+ jedeux-.

L'intoxication aiguë au trioxyde d'arsenic se produit par ingestion ou inhalation, dont les manifestations les plus importantes sont: troubles gastro-intestinaux sévères, crampes, collapsus circulatoire et œdème pulmonaire..
Cependant, malgré sa toxicité, il a été utilisé industriellement; par exemple, dans la conservation du bois, dans la production de pigments, de semi-conducteurs, etc. De même, il était autrefois utilisé dans le traitement de nombreuses maladies.
Le trioxyde d'arsenic est un composé amphotère, soluble dans les acides dilués et les alcalis, insoluble dans les solvants organiques et relativement soluble dans l'eau. Il se présente sous la forme d'un solide (image du haut), avec deux formes cristallines: cubique et monoclinique.
Index des articles
- 1 Structure du trioxyde d'arsenic
- 1.1 Claudétite
- 1.2 Liquide et gazeux
- 1.3 Arsénolite
- 2 propriétés
- 2.1 Noms commerciaux
- 2.2 Poids moléculaire
- 2.3 Apparence physique
- 2.4 Odeur
- 2.5 Saveur
- 2.6 Point d'ébullition
- 2.7 Point de fusion
- 2.8 Point d'éclair
- 2.9 Solubilité dans l'eau
- 2.10 Solubilité
- 2.11 Densité
- 2.12 Pression de vapeur
- 2.13 Décomposition
- 2.14 Corrosivité
- 2.15 Chaleur de vaporisation
- 2.16 Constante de dissociation (Ka)
- 2.17 Indice de réfraction
- 3 Réactivité
- 4 Nomenclature
- 5 utilisations
- 5.1 Industriel
- 5.2 Médecins
- 6 Références
Structure du trioxyde d'arsenic
Claudetita
À température ambiante, commedeuxOU ALORS3 cristallise en deux polymorphes monocliniques, tous deux trouvés dans la claudétite minérale. Ils ont des unités de pyramide trigonale AsO3, qui sont joints par leurs atomes d'oxygène pour compenser le déficit électronique de l'unité à elle seule.
Dans un polymorphe les unités AsO3 ils sont liés formant des rangées (claudetite I), et dans l'autre ils sont liés comme s'ils tissaient un filet (claudetite II):
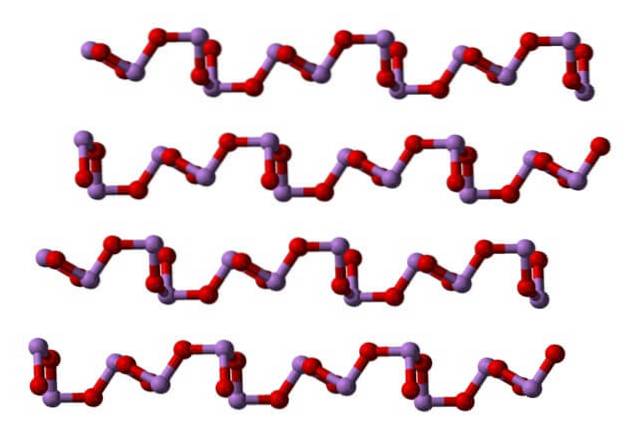
Liquide et gazeux
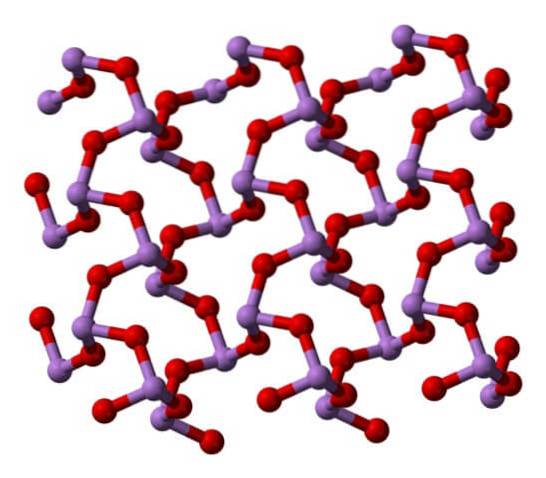
Lorsque toutes ces structures qui définissent les cristaux monocliniques sont chauffées, les vibrations sont telles que plusieurs liaisons As-O sont rompues et une molécule plus petite finit par prévaloir:4OU ALORS6. Sa structure est montrée dans l'image ci-dessous.

On pourrait dire qu'il se compose d'un dimère d'AsdeuxOU ALORS3. Sa stabilité est telle qu'il supporte 800 ° C en phase gazeuse; mais, au-dessus de cette température, il se fragmente en molécules AsdeuxOU ALORS3.
Arsénolite
Le même as4OU ALORS6 peuvent interagir les uns avec les autres pour cristalliser en un solide cubique dont la structure se trouve dans l'arsénolite minéral.
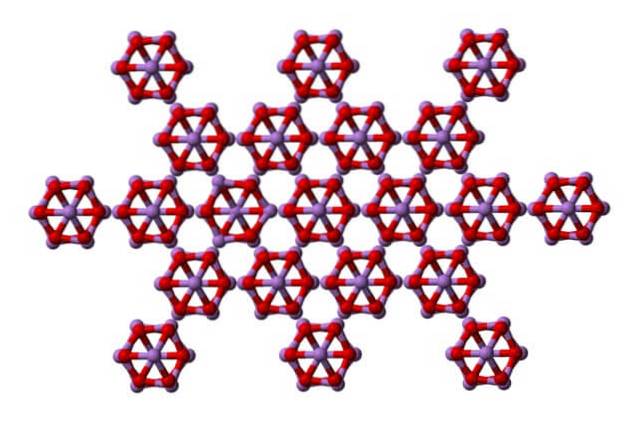
Notez que l'image montre la structure depuis un plan plus élevé. En comparaison avec la claudétite, sa différence structurelle avec l'arsénolite est évidente. Ici, ce sont des molécules discrètes d'As4OU ALORS6 que les unités sont maintenues par les forces de Van der Waals.
Propriétés
Appellations commerciales
-Arsénolite
-Arsodent
-Trisenox
-Claudetita
Poids moléculaire
197,84 g / mol.
Aspect physique
-Cristaux cubiques blancs (arsénolite).
-Cristaux monocliniques incolores (Claudetite).
-Grumeaux solides, vitreux, amorphes blancs ou transparents ou poudre cristalline.
Odeur
Toilette.
Goût
Insipide.
Point d'ébullition
460 ºC.
Point de fusion
-313 ºC (claudétite).
-274 ºC (Arsénolite).
point d'allumage
485 º C (sublime).
Solubilité dans l'eau
17 g / L à 18 ºC (20 g / L à 25 ºC).
Solubilité
Soluble dans les acides (en particulier l'acide chlorhydrique) et les alcalis. Pratiquement insoluble dans le chloroforme et l'éther.
Densité
-3,85 g / cm3 (cristaux cubiques);
-4,15 g / cm3 (cristaux rhombiques).
La pression de vapeur
2,47 10-4 mmHg à 25 ºC.
Décomposition
Il n'est pas combustible, mais lorsqu'il est chauffé, il peut créer une fumée toxique pouvant inclure de l'arsine..
Corrosivité
En présence d'humidité, il peut être corrosif pour les métaux.
Chaleur de vaporisation
77 kJ / mol.
Constante de dissociation (Ka)
1 110-4 à 25 ºC.
Indice de réfraction
-1 755 (arsénolite)
-1.92-2.01 (claudétite).
Réactivité
-Le trioxyde d'arsenic est un composé amphotère, mais il fonctionne préférentiellement comme un acide.
-Peut réagir avec l'acide chlorhydrique ou l'acide fluorhydrique, formant du trichlorure d'arsenic ou du trifluorure d'arsenic.
-De même, il réagit avec les oxydants forts, tels que l'acide nitrique, provoquant l'acide arsénique et l'oxyde nitreux..
-Le trioxyde d'arsenic peut réagir avec l'acide nitrique, produisant de l'arsine ou l'élément arsenic, selon les conditions de réaction..
AsdeuxOU ALORS3 + 6 Zn + 12 HNO3 => 2 AsH3 + 6 Zn (NON3)deux + 3 HdeuxOU ALORS.
Cette réaction a servi de base à la création du Marsh Test, utilisé pour détecter les intoxications à l'arsenic..
Nomenclature
ÀdeuxOU ALORS3 Il peut être nommé selon les nomenclatures suivantes, sachant que l'arsenic fonctionne avec la valence +3:
-Oxyde d'arseneux (nomenclature traditionnelle).
-Oxyde d'arsenic (III) (nomenclature de base).
-Trioxyde diarsénique (nomenclature systématique).
Applications
Industriel
-Il est utilisé dans la fabrication du verre, notamment comme agent de blanchiment. Il est également utilisé dans la fabrication de céramiques, de produits électroniques et de feux d'artifice.
-Il est ajouté en tant que composant mineur aux alliages à base de cuivre, pour augmenter la résistance à la corrosion des métaux d'alliage.
-La glacedeuxOU ALORS3 est le matériau de départ pour la préparation de l'arsenic élémentaire, pour améliorer les connexions électriques et pour la production de semi-conducteurs d'arséniure
-La glacedeuxOU ALORS3, ainsi que l'arséniate de cuivre, ils sont utilisés comme agents de préservation du bois. Il a été utilisé en combinaison avec de l'acétate de cuivre pour fabriquer le pigment vert de Paris, utilisé pour fabriquer des peintures et des rodenticides..
Médecins
-Le trioxyde d'arsenic est un composé utilisé depuis des siècles dans le traitement de nombreuses maladies. Il était utilisé comme tonique dans le traitement des troubles nutritionnels, des névralgies, des rhumatismes, de l'arthrite, de l'asthme, de la chorée, du paludisme, de la syphilis et de la tuberculose.
-De même, il a été utilisé dans le traitement local des maladies de la peau, étant utilisé pour détruire certains épithéliomes superficiels..
-La solution de Fowler a été utilisée pour traiter les maladies de la peau et la leucémie. L'utilisation de ce médicament est interrompue..
-Dans les années 1970, le chercheur chinois Zhang Tingdong a mené des recherches sur l'utilisation du trioxyde d'arsenic dans le traitement de la leucémie aiguë promyélocytaire (LPA). Ce qui a conduit à la production du médicament Trisenox, qui a été approuvé par la FDA américaine.
-Trisenox a été utilisé chez les patients atteints de LPA qui ne répondent pas au traitement de «première intention», consistant en acide tout-trans rétinoïque (ATRA). Il a été démontré que le trioxyde d'arsenic induisait l'apoptose des cellules cancéreuses.
-Trisenox est utilisé comme cytostatique dans le traitement du sous-type réfractaire promyélocytaire (M3) par APL.
Les références
- Shen et coll. (2001). Études sur l'efficacité clinique et la pharmacocinétique du trioxyde d'arsenic à faible dose dans le traitement de la leucémie promyélocytaire aiguë récidivante: une comparaison avec la posologie conventionnelle. Leucémie 15, 735-741.
- Science Direct. (2014). Trioxyde d'arsenic. Le Sevier. Récupéré de: sciencedirect.com
- Wikipédia. (2019). Trioxyde d'arsenic. Récupéré de: en.wikipedia.org
- PubChem. (2019). Oxyde d'arsenic (III). Récupéré de: pubchem.ncbi.nlm.nih.gov
- Deborah M. Rusta et Steven L. Soignetb. (2001). Profil risques / avantages du trioxyde d'arsenic. L'oncologue vol. 6 Supplément 2 29-32.
- Le journal de médecine de la Nouvelle-Angleterre. (11 Juillet 2013). Acide rétinoïque et trioxyde d'arsenic pour la leucémie promyélocytaire aiguë. n engl j med 369; 2.



Personne n'a encore commenté ce post.