
Structure de l'oxyde de phosphore (v), propriétés, obtention, utilisations, risques

le oxyde de phosphore (v) C'est un solide inorganique formé de phosphore (P) et d'oxygène (O). Sa formule empirique est PdeuxOU ALORS5, tandis que sa formule moléculaire correcte est P4OU ALORSdix. C'est un solide blanc très hygroscopique, c'est-à-dire qu'il peut très facilement absorber l'eau de l'air et réagir immédiatement avec lui. La réaction peut être dangereuse car elle provoque une augmentation rapide de la température.
Sa forte tendance à absorber l'eau l'a amené à être utilisé comme agent desséchant dans les laboratoires de chimie, ainsi que comme déshydrateur de certains composés, c'est-à-dire pour éliminer l'eau de ses molécules..

L'oxyde de phosphore (v) est également utilisé pour accélérer les réactions de liaison de diverses molécules d'hydrocarbures, une réaction appelée condensation. De plus, il permet de convertir certains acides organiques en esters.
Il a été utilisé par exemple pour raffiner l'essence, pour préparer l'acide phosphorique H3PO4, pour obtenir des composés qui servent à retarder le feu, pour fabriquer du verre pour des applications sous vide, parmi de nombreuses autres utilisations.
L'oxyde de phosphore (v) doit être conservé dans des récipients hermétiquement fermés pour éviter qu'il n'entre en contact avec l'humidité de l'air. Il est corrosif et peut endommager les yeux, la peau et les muqueuses..
Index des articles
- 1 Structure
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Point de fusion
- 3.4 Température de sublimation
- 3.5 Densité
- 3.6 Solubilité
- 3.7 Propriétés chimiques
- 3.8 Autres propriétés
- 4 Obtention
- 4.1 Présence dans la nature
- 5 utilisations
- 5.1 En tant qu'agent déshydratant et desséchant
- 5.2 Dans les réactions de chimie organique
- 5.3 Dans le raffinage du carburant
- 5.4 Dans diverses applications
- 6 risques
- 7 Références
Structure
L'oxyde de phosphore (v) est composé de phosphore (P) et d'oxygène (O), où le phosphore a une valence de +5 et de l'oxygène -2. La molécule d'oxyde de phosphore (v) a quatre atomes de phosphore et dix atomes d'oxygène et c'est pourquoi sa formule moléculaire correcte est P4OU ALORSdix.
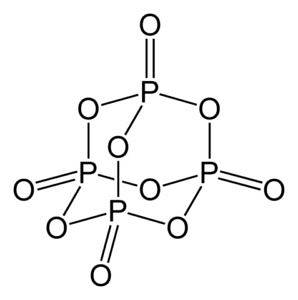
Il existe sous trois formes cristallines, sous forme de poudre amorphe et sous forme vitreuse (sous forme de verre). Dans la forme cristalline hexagonale, chacun des atomes de phosphore se trouve aux sommets d'un tétraèdre..
Nomenclature
- Oxyde de phosphore (v)
- Pentoxyde de phosphore
- Pentoxyde de diphosphore
- Pentoxyde phosphorique
- Anhydride phosphorique
- Décaoxyde de tétraphosphore
Propriétés
État physique
Solide blanc cristallin. La forme la plus courante est celle des cristaux hexagonaux.
Poids moléculaire
283,89 g / mol
Point de fusion
562 ºC
Température de sublimation
360 ºC à une pression de 1 atmosphère. Cela signifie qu'à cette température il passe du solide au gaz sans passer par l'état liquide.
Densité
2,30 g / cm3
Solubilité
Très soluble dans l'eau. Soluble dans l'acide sulfurique. Insoluble dans l'acétone et l'ammoniaque.
Propriétés chimiques
L'oxyde de phosphore (v) absorbe et réagit avec l'eau dans l'air extrêmement rapidement, formant de l'acide phosphorique H3PO4. Cette réaction est exothermique, ce qui signifie que de la chaleur est produite pendant la réaction..
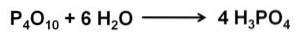
La réaction de P4OU ALORSdix avec de l'eau conduit à la formation d'un mélange d'acides phosphoriques dont la composition dépend de la quantité d'eau et des conditions.
La réaction avec les alcools conduit à la formation d'esters d'acide phosphorique ou d'acides polymériques selon les conditions expérimentales..
P4OU ALORSdix + 6 ROH → 2 (RO)deuxPO.OH + 2 RO.PO (OH)deux
Avec les oxydes basiques, il forme des phosphates solides.
C'est corrosif. Peut réagir dangereusement avec l'acide formique et les bases inorganiques telles que l'hydroxyde de sodium (NaOH), l'oxyde de calcium (CaO) ou le carbonate de sodium NadeuxCO3.
Si vous versez une solution d'acide perchlorique HClO4 et chloroforme CHCl3 en oxyde de phosphore (v) P4OU ALORSdix une violente explosion se produit.
Autres propriétés
Ce n'est pas inflammable. Il ne favorise pas la combustion. Cependant, sa réaction avec l'eau est si violente et exothermique qu'il peut y avoir un risque d'incendie..
Obtention
Il peut être préparé par oxydation directe du phosphore dans un courant d'air sec. Le phosphore lorsqu'il entre en contact avec un excès d'oxygène s'oxyde en formant de l'oxyde de phosphore (v).
P4 + 5 Odeux → P4OU ALORSdix
Présence dans la nature
L'oxyde de phosphore (v) se trouve dans des minéraux tels que l'ilménite, le rutile et le zircon.
L'ilménite est un minéral qui contient du fer et du titane et qui contient parfois de l'oxyde de phosphore (v) à des concentrations variant entre 0,04 et 0,33% en poids. Le rutile est un minéral d'oxyde de titane et peut contenir environ 0,02% en poids de PdeuxOU ALORS5.
Les sables de zircon (un minéral de l'élément zirconium) ont de l'oxyde de phosphore (v) à 0,05-0,39% en poids.
Applications
En tant qu'agent déshydratant et desséchant
En raison de sa grande avidité pour l'eau, c'est l'un des agents déshydratants les plus connus et très efficace à des températures inférieures à 100 ° C..
Il peut extraire l'eau de substances qui sont elles-mêmes considérées comme des agents déshydratants. Par exemple, vous pouvez éliminer l'eau de l'acide sulfurique HdeuxSW4 le transformer en SO3 et acide nitrique HNO3 le transformer en NdeuxOU ALORS5.

Fondamentalement, il peut sécher tous les liquides et gaz avec lesquels il ne réagit pas, il permet donc d'éliminer les traces d'humidité des systèmes de vide..
Dans les réactions de chimie organique
L'oxyde de phosphore (v) sert à fermer les anneaux de composés organiques et d'autres réactions de condensation.
Il permet d'estérifier les acides organiques avec la possibilité de distinguer les acides carboxyliques aliphatiques primaires (chaîne carbonée sans cycle avec le groupement -COOH à une extrémité) et les acides aromatiques (groupement -COOH attaché au cycle benzénique), car ces derniers ne réagissent pas.
Il sert également à éliminer une molécule de HdeuxO des amides R (C = O) NHdeux et les convertit en nitriles R-CN. De plus, il catalyse ou accélère les réactions d'oxygénation, de déshydrogénation et de polymérisation du bitume.

Dans le raffinage du carburant
Depuis les années 30 du 20e siècle, certaines études ont indiqué que l'oxyde de phosphore (v) exerçait une action de raffinage sur l'essence, augmentant son indice d'octane.
L'action raffinante de P4OU ALORSdix elle est principalement due à des réactions de condensation (union de molécules différentes) et non à une polymérisation (union de molécules égales).
Le p4OU ALORSdix accélère l'alkylation directe des hydrocarbures aromatiques avec les oléfines, la conversion des oléfines en naphtènes et leur polymérisation partielle. La réaction d'alkylation augmente l'indice d'octane de l'essence.
De cette manière, une essence raffinée de haute qualité est obtenue.

Dans diverses applications
L'oxyde de phosphore (v) est utilisé pour:
- Préparer l'acide phosphorique H3PO4
- Obtenir des esters d'acrylate et des tensioactifs
- Préparer des esters de phosphate qui sont utilisés comme retardateurs de flamme, solvants et diluants
- Conversion du trichlorure de phosphore en oxychlorure de phosphore
- Réactif de laboratoire
- Fabrication de verre spécial pour tubes à vide
- Augmenter le point de fusion de l'asphalte
- Servir de molécule standard dans la détermination du phosphore ou des phosphates dans la roche phosphatée, les engrais et le ciment Portland, sous forme de PdeuxOU ALORS5
- Améliorer les liaisons entre certains polymères et la couche d'ivoire des dents

Des risques
L'oxyde de phosphore (v) doit être conservé dans des conteneurs scellés et dans des endroits frais, secs et bien ventilés.
Cela sert à l'empêcher d'entrer en contact avec l'eau, car il peut réagir violemment avec elle, générant beaucoup de chaleur, au point de brûler des matériaux combustibles à proximité..
La poussière d'oxyde de phosphore (v) est irritante pour les yeux et les voies respiratoires et corrosive pour la peau. Peut causer des brûlures aux yeux. L'ingestion provoque des brûlures internes mortelles.
Les références
- NOUS. Bibliothèque nationale de médecine. (2019). Anhydride phosphorique. Récupéré de pubchem.ncbi.nlm.nih.gov.
- Nayler, P. (2001). Bitumes: modifiés. Modification chimique. Dans Encyclopédie des matériaux: science et technologie. Récupéré de sciencedirect.com.
- Malishev, B.W. (1936). Pentoxyde de phosphore comme agent de raffinage de l'essence. Chimie industrielle et technique 1936, 28, 2, 190-193. Récupéré de pubs.acs.org.
- Epps, Jr. E.A. (1950). Détermination photométrique du pentoxyde de phosphore disponible dans les engrais. Analytical Chemistry 1950, 22, 8, 1062-1063. Récupéré de pubs.acs.org.
- Banerjee, A. et coll. (1983). Utilisation du pentoxyde de phosphore: estérification des acides organiques. J. Org. Chem. 1983, 48, 3108-3109. Récupéré de pubs.acs.org.
- Cotton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley et fils.
- Kirk-Othmer (1994). Encyclopédie de la technologie chimique. Quatrième édition. John Wiley et fils.
- Ogliari, F.A. et coll. (2008). Synthèse de monomères de phosphate et liaison à la dentine: méthodes d'estérification et utilisation de l'anhydride phosphorique. Journal of Dentistry, volume 36, numéro 3, mars 2008, pages 171-177. Récupéré de sciencedirect.com.



Personne n'a encore commenté ce post.