
Formule d'oxyde de lithium, propriétés, risques et utilisations

le oxyde de lithium C'est un composé chimique inorganique de formule LideuxOu cela se forme avec de petites quantités de peroxyde de lithium lorsque le lithium métallique brûle dans l'air et se combine avec l'oxygène..
Jusque dans les années 1990, le marché des métaux et du lithium était dominé par la production américaine à partir de gisements minéraux, mais au début du 21e siècle, la plus grande partie de la production provenait de sources non américaines; L'Australie, le Chili et le Portugal étaient les principaux fournisseurs du monde. La Bolivie possède la moitié des gisements de lithium dans le monde, mais ce n'est pas un gros producteur.
La forme commerciale la plus importante est le carbonate de lithium, LideuxCO3, produit à partir de minéraux ou de saumures par plusieurs procédés différents.
Lorsque le lithium est brûlé dans l'air, le produit principal est l'oxyde blanc d'oxyde de lithium, LideuxO. En outre, du peroxyde de lithium est produit, LideuxOU ALORSdeux, aussi blanc.
Cela peut également être fait par la décomposition thermique de l'hydroxyde de lithium, LiOH ou du peroxyde de lithium, Li2O2.
4Li (s) + Odeux(g) → 2LideuxToi)
2LiOH (s) + chaleur → LideuxO (s) + HdeuxO (g)
2LideuxOU ALORSdeux(s) + chaleur → 2LideuxO (s) + Odeux(g)
Proprietes physiques et chimiques
L'oxyde de lithium est un solide blanc connu sous le nom de lithie qui manque d'arôme et a un goût salé. Son aspect est illustré à la figure 2 (National Center for Biotechnology Information, 2017).

Figure 2: aspect de l'oxyde de lithium
Les oxydes de lithium sont des cristaux avec une géométrie antiflorite similaire au chlorure de sodium (cubique à faces centrées). Sa structure cristalline est présentée dans la figure 3 (Mark Winter [The University of Sheffield and WebElements Ltd, 2016).
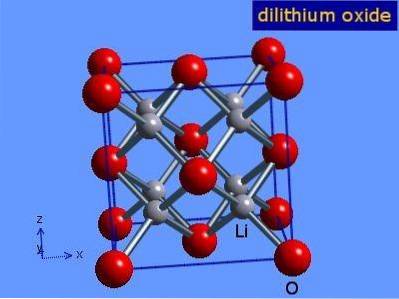
Figure 3: structure cristalline de l'oxyde de lithium.
Son poids moléculaire est de 29,88 g / mol, sa densité de 2,013 g / ml et ses points de fusion et d'ébullition sont respectivement de 1438 ºC et 2066 ºC. Le composé est très soluble dans l'eau, l'alcool, l'éther, la pyridine et le nitrobenzène (Royal Society of Chemistry, 2015).
L'oxyde de lithium réagit facilement avec la vapeur d'eau pour former de l'hydroxyde et avec le dioxyde de carbone pour former du carbonate; par conséquent, il doit être stocké et manipulé dans une atmosphère propre et sèche..
Les composés oxydés ne conduisent pas l'électricité. Cependant, certains oxydes structurés de pérovskite sont des conducteurs électroniques qui trouvent une application dans la cathode des piles à combustible à oxyde solide et des systèmes de génération d'oxygène..
Ce sont des composés qui contiennent au moins un anion oxygène et un cation métallique (American Elements, S.F.).
Réactivité et dangers
L'oxyde de lithium est un composé stable incompatible avec les acides forts, l'eau et le dioxyde de carbone. À notre connaissance, les propriétés chimiques, physiques et toxicologiques de l'oxyde de lithium n'ont pas été complètement étudiées et rapportées..
La toxicité des composés du lithium est fonction de leur solubilité dans l'eau. L'ion lithium a une toxicité pour le système nerveux central. Le composé est très corrosif et irritant s'il entre en contact avec les yeux, la peau, lorsqu'il est inhalé ou ingéré (ESPI METALS, 1993).
En cas de contact avec les yeux, vérifiez si vous portez des lentilles de contact et retirez-les immédiatement. Les yeux doivent être rincés à l'eau courante pendant au moins 15 minutes, en gardant les paupières ouvertes. De l'eau froide peut être utilisée. La pommade oculaire ne doit pas être utilisée.
Si le produit chimique entre en contact avec les vêtements, retirez-le le plus rapidement possible, en protégeant vos mains et votre corps. Placer la victime sous une douche de sécurité.
Si le produit chimique s'accumule sur la peau exposée de la victime, comme les mains, la peau contaminée est lavée doucement et soigneusement à l'eau courante et au savon non abrasif. De l'eau froide peut être utilisée. Si l'irritation persiste, consulter un médecin. Lavez les vêtements contaminés avant de les réutiliser.
En cas d'inhalation, la victime doit être autorisée à se reposer dans un endroit bien ventilé. Si l'inhalation est sévère, la victime doit être évacuée vers une zone sûre dès que possible..
Desserrez les vêtements serrés comme un col de chemise, une ceinture ou une cravate. Si la victime a du mal à respirer, de l'oxygène doit être administré. Si la victime ne respire pas, une réanimation bouche-à-bouche est effectuée.
Gardez toujours à l'esprit qu'il peut être dangereux pour la personne aidant de pratiquer la réanimation bouche-à-bouche lorsque le produit inhalé est toxique, infectieux ou corrosif..
Dans tous les cas, une attention médicale immédiate doit être recherchée (SIGMA-ALDRICH, 2010).
Applications
L'oxyde de lithium est utilisé comme fondant dans les glaçures céramiques et crée des bleus avec du cuivre et des roses avec du cobalt. L'oxyde de lithium réagit avec l'eau et la vapeur pour former de l'hydroxyde de lithium et doit en être isolé.
Oxyde de lithium (LideuxO) avec son potentiel tritium élevé est un candidat attractif pour le matériel de culture solide d'une centrale à fusion DT, en raison de sa haute densité d'atomes de lithium (par rapport à d'autres céramiques au lithium ou lithium métal) et sa conductivité thermique relativement élevée (OXYDE DE LITHIUM (Li2O), SF).
LideuxOu il sera exposé à des températures élevées sous irradiation neutronique pendant le fonctionnement de la couverture de fusion. Dans ces circonstances, un grand nombre de défauts d'irradiation se produira dans LideuxOu, comme le gonflement induit par l'hélium, la dilatation thermique relativement élevée, la croissance des grains, la formation de LiOH (T) et les précipitations à basses températures et le transport de masse de LiOH (T) à hautes températures.
En outre, le LideuxOu il sera soumis à des contraintes résultant de différences de dilatation thermique entre LideuxOu et matériaux de structure. Ces caractéristiques de LideuxOu conduire à des problèmes d'ingénierie difficiles à la fois dans la fabrication et la conception des couvertures.
Une nouvelle utilisation possible consiste à remplacer l'oxyde de lithium-cobalt en tant que cathode dans les batteries lithium-ion utilisées pour alimenter les appareils électroniques des téléphones mobiles aux ordinateurs portables ainsi qu'aux voitures alimentées par batterie (Reade International Corp, 2016)..
Les références
- Mark Winter [Université de Sheffield et WebElements Ltd. (2016). Webelements. Tiré du lithium: oxyde de dilithium webelements.com.
- Éléments américains. (S.F.). Oxyde de lithium. Tiré de americanelements americanelements.com.
- MÉTAUX ESPI. (1993, juin). Oxyde de lithium. Tiré de espimetals espimetals.com.
- OXYDE DE LITHIUM (Li2O). (S.F.). Tiré de ferp.ucsd.edu ferp.ucsd.edu.
- Centre national d'information sur la biotechnologie. (24 juin 2017). Base de données des composés PubChem; CID = 166630. Tiré de PubChem pubchem.ncbi.nlm.nih.gov.
- Reade International Corp. (2016). Poudre d'oxyde de lithium (Li2O). Tiré de reade reade.com
- Société royale de chimie. (2015). Oxyde de lithium.Tiré de chemspiderchemspider.com.
- SIGMA-ALDRICH. (2010). Fiche signalétique Oxyde de lithium. Tiré de chemblink chemblink.com.


Personne n'a encore commenté ce post.