
Structure, propriétés, synthèse de l'acétanilide (C8H9NO)
La acétanilide (C8H9NO) est un amide aromatique qui reçoit plusieurs noms supplémentaires: N-acétylarylamine, N-phénylacétamide et acétanil. Il se présente comme un solide inodore sous forme de flocons, sa nature chimique est un amide et, en tant que tel, il peut former des gaz inflammables lorsqu'il réagit avec des agents réducteurs puissants..
De plus, c'est une base faible, pouvant réagir avec des agents déshydratants tels que PdeuxOU ALORS5 pour donner naissance à un nitrile. L'acétanilide s'est avéré avoir une action analgésique et antipyrétique et a été utilisé en 1886 sous le nom d'Antifebrina par A. Cahn et P. Hepp..

En 1899, l'acide acétylsalicylique (aspirine) a été introduit sur le marché, qui avait les mêmes actions thérapeutiques que l'acétanilide. L'utilisation d'acétanilide étant liée à l'apparition de cyanose chez les patients - conséquence de la méthémoglobinémie induite par l'acétanilide - son utilisation a été exclue..
Par la suite, il a été établi que l'action analgésique et antipyrétique de l'acétanilide résidait dans un métabolite de celui-ci appelé paracétamol (acétoaminophène), qui n'avait pas ses effets toxiques, comme le suggèrent Axelrod et Brodie..
Index des articles
- 1 Structure chimique
- 1.1 Structures de résonance et interactions intermoléculaires
- 2 Propriétés chimiques
- 2.1 Poids moléculaire
- 2.2 Description chimique
- 2.3 Odeur
- 2.4 Saveur
- 2.5 Point d'ébullition
- 2.6 Point de fusion
- 2.7 Point d'éclair ou point d'éclair
- 2.8 Densité
- 2.9 Densité de vapeur
- 2.10 Pression de vapeur
- 2.11 Stabilité
- 2.12 Volatilité
- 2.13 Auto-inflammation
- 2.14 Décomposition
- 2,15 pH
- 2.16 Solubilité
- 3 Synthèse
- 4 applications
- 5 Références
Structure chimique
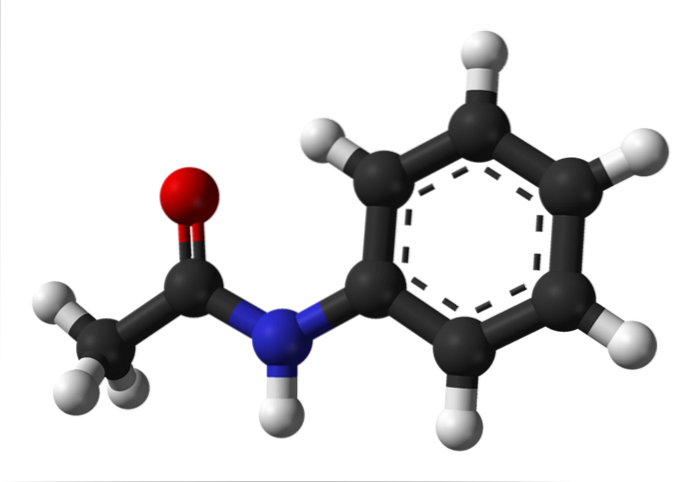
L'image du haut représente la structure chimique de l'acétanilide. À droite se trouve le cycle aromatique hexagonal du benzène (avec des lignes pointillées), et à gauche la raison pour laquelle le composé est constitué d'un amide aromatique: le groupe acétamido (HNCOCH3).
Le groupe acétamido confère au cycle benzénique un caractère polaire plus important; c'est-à-dire qu'il crée un moment dipolaire dans la molécule d'acétanilide.
Parce que? Parce que l'azote est plus électronégatif que n'importe lequel des atomes de carbone du cycle et est également lié au groupe acyle, dont l'atome O attire également la densité électronique.
D'autre part, presque toute la structure moléculaire de l'acétanilide repose sur le même plan en raison de l'hybridation spdeux des atomes qui le composent.
Il existe une exception liée à celles du groupe -CH3, dont les atomes d'hydrogène constituent les sommets d'un tétraèdre (les sphères blanches à l'extrême gauche sortent du plan).
Structures de résonance et interactions intermoléculaires
La paire isolée sans partage dans l'atome N circule à travers le système π du cycle aromatique, à l'origine de plusieurs structures de résonance. Cependant, l'une de ces structures se retrouve avec une charge négative sur l'atome O (plus électronégative) et une charge positive sur l'atome N..
Ainsi, il existe des structures de résonance où une charge négative se déplace dans l'anneau, et une autre où elle réside dans l'atome O. En conséquence de cette «asymétrie électronique» -qui va de pair avec une asymétrie moléculaire-, l'acétanilide interagit de manière intermoléculaire par dipôle -dipolaires forces.
Cependant, les interactions de liaison hydrogène (N-H-O-…) entre deux molécules d'acétanilide sont, en fait, la force prédominante dans leur structure cristalline..
Ainsi, les cristaux d'acétanilide sont constitués de cellules unitaires orthorhombiques de huit molécules orientées en forme de «ruban plat» par leurs liaisons hydrogène..
Cela peut être visualisé en plaçant une molécule d'acétanilide sur l'autre, en parallèle. Donc, comme les groupes HNCOCH3 se chevauchent spatialement, ils forment des liaisons hydrogène.
De plus, entre ces deux molécules une troisième peut également "glisser", mais avec son anneau aromatique pointant vers le côté opposé..
Propriétés chimiques
Poids moléculaire
135,166 g / mol.
Description chimique
Blanc uni ou blanc cassé. Forme des flocons blancs brillants ou une poudre cristalline blanche.
Odeur
Toilette.
Goût
Légèrement épicé.
Point d'ébullition
304 ° C à 760 mmHg (579 ° F à 760 mmHg).
Point de fusion
114,3 ° C (237,7 ° F).
Point d'éclair ou point d'éclair
169 ° C (337 ° F). Mesure réalisée en verre ouvert.
Densité
1219 mg / mL à 15 ° C (1219 mg / mL à 59 ° F)
Densité de vapeur
4,65 par rapport à l'air.
La pression de vapeur
1 mmHg à 237 ° F, 1,22 × 10-3 mmHg à 25 ° C, 2Pa à 20 ° C.
Stabilité
Il subit un réarrangement chimique lorsqu'il est exposé à la lumière UV. Comment la structure change-t-elle? Le groupe acétyle forme de nouvelles liaisons sur le cycle aux positions ortho et para. De plus, il est stable à l'air et incompatible avec les agents oxydants puissants, les caustiques et les alcalis..
Volatilité
Sensiblement volatil à 95 ºC.
Auto-inflammation
1004 ° F.
Décomposition
Il se décompose lorsqu'il est chauffé, émettant une fumée hautement toxique.
pH
5-7 (10 g / L de HdeuxOu à 25 ºC)
Solubilité
- Dans l'eau: 6,93 × 103 mg / mL à 25 ºC.
- Solubilité de 1 g d'acétanilide dans différents liquides: dans 3,4 ml d'alcool, 20 ml d'eau bouillante, 3 ml de méthanol, 4 ml d'acétone, 0,6 ml d'alcool bouillant, 3,7 ml de chloroforme, 5 ml de gliecérol, 8 ml de dioxane, 47 ml de benzène et 18 ml d'éther. L'hydrate de chloral augmente la solubilité de l'acétanilide dans l'eau.
La synthèse
Il est synthétisé en faisant réagir l'anhydride acétique avec de l'acétanilide. Cette réaction apparaît dans de nombreux textes de chimie organique (Vogel, 1959):
C6H5NHdeux + (CH3CO)deuxO => C6H5NHCOCH3 + CH3COOH
Applications
-C'est un agent inhibiteur du processus de décomposition du peroxyde d'hydrogène (peroxyde d'hydrogène).
-Stabilise les vernis à l'ester de cellulose.
-Il intervient en tant qu'intermédiaire dans l'accélération de la production de caoutchouc. De même, c'est un intermédiaire dans la synthèse de certains colorants et du camphre..
-Agit comme précurseur dans la synthèse de la pénicilline.
-Il est utilisé dans la production de chlorure de 4-acétamidosulfonylbenzène. L'acétanilide réagit avec l'acide chlorosulfonique (HSO3Cl), produisant ainsi du chlorure de 4-aminosulfonylbenzène. Celui-ci réagit avec l'ammoniac ou une amine organique primaire pour former des sulfamides..
-Il a été utilisé à titre expérimental au 19ème siècle dans le développement de la photographie.
-L'acétanilide est utilisé comme marqueur des flux électroosmotiques (EOF) en électrophorèse capillaire pour l'étude du lien entre médicaments et protéines..
-Récemment (2016), l'acétanilide a été lié au 1- (ω-phénoxyalkyluracile) dans des expériences pour inhiber la réplication du virus de l'hépatite C. L'acétanilide se lie à la position 3 du cycle pyrimidine.
-Les résultats expérimentaux indiquent une réduction de la réplication du génome viral, quel que soit le génotype viral..
-Avant que la toxicité de l'acétanilide ne soit identifiée, il a été utilisé comme analgésique et antipyrétique à partir de 1886. Plus tard (1891), il a été utilisé dans le traitement de la bronchite chronique et aiguë par Grün.
Les références
- J. Brown et D. E. C. Corbridge. (1948). Structure cristalline de l'acétanilide: utilisation du rayonnement infrarouge polarisé. Nature volume 162, page 72. doi: 10.1038 / 162072a0.
- Grün, E. F. (1891) L'utilisation de l'acétanilide dans le traitement de la bronchite aiguë et chronique. Lancette 137 (3539): 1424-1426.
- Magri, A. et coll. (2016). Exploration de dérivés d'acétanilide de 1- (ω-phénoxyalkyl) uraciles comme nouveaux inhibiteurs de la réplication du virus de l'hépatite C. Sei. Rep. 6, 29487; doi: 10.1038 / srep29487.
- Merck KGaA. (2018). Acétanilide. Extrait le 5 juin 2018 de: sigmaaldrich.com
- Rapport d'évaluation initiale des PEID pour le 13e SIAM. Acétanilide. [PDF]. Extrait le 5 juin 2018 de: inchem.org
- Wikipédia. (2018). Acétanilide. Extrait le 5 juin 2018 de: en.wikipedia.org
- PubChem. (2018). Acétanilide. Extrait le 5 juin 2018 de: pubchem.ncbi.nlm.nih.gov

Personne n'a encore commenté ce post.