
Structure des alcanes linéaires, propriétés, nomenclature, exemples
Les alcanes linéaires sont des hydrocarbures saturés dont la formule chimique générale est n-CnH2n + 2. Comme ce sont des hydrocarbures saturés, toutes leurs liaisons sont simples (C-H) et ne sont composées que d'atomes de carbone et d'hydrogène. Ils sont également appelés paraffines, ce qui les différencie des alcanes ramifiés, appelés isoparaffines..
Ces hydrocarbures sont dépourvus de branches et d'anneaux. Plus que des lignées, cette famille de composés organiques ressemble plus à des chaînes (Alcane à chaîne droite); ou sous l'angle culinaire, aux spaghettis (crus et cuits).

Les spaghettis crus en viennent à représenter l'état idéal et isolé des alcanes linéaires, bien qu'avec une tendance prononcée à se casser; tandis que ceux cuits, qu'ils soient al dente ou non, se rapprochent de leur état naturel et synergique: certains interagissent avec d'autres dans un tout (le plat de pâtes, par exemple).
Ces types d'hydrocarbures se trouvent naturellement dans le gaz naturel et dans les champs pétrolifères. Les plus légers présentent des caractéristiques lubrifiantes, tandis que les plus lourds se comportent comme un asphalte indésirable; soluble, cependant, dans les paraffines. Ils servent très bien de solvants, de lubrifiants, de carburants et d'asphalte.
Index des articles
- 1 Structure des alcanes linéaires
- 1.1 Groupes
- 1.2 Longueurs de vos chaînes
- 1.3 Conformations
- 2 propriétés
- 2.1 Physique
- 2.2 Interactions
- 2.3 Stabilité
- 3 Nomenclature
- 4 exemples
- 5 Références
Structure des alcanes linéaires
Groupes
Il a été mentionné que la formule générale de ces alcanes est CnH2n + 2. Cette formule est en fait la même pour tous les alcanes, qu'ils soient linéaires ou ramifiés. La différence alors dans le n- qui précède la formule de l'alcane, dont la dénotation signifie «normal».
On verra plus tard que ce n- il n'est pas nécessaire pour les alcanes dont le nombre de carbones est égal ou inférieur à quatre (n ≤ 4).
Une ligne ou une chaîne ne peut pas être constituée d'un seul atome de carbone, donc le méthane (CH4, n = 1). Si n = 2, nous avons l'éthane, CH3-CH3. Notez que cet alcane se compose de deux groupes méthyle, CH3, liés ensemble.
L'augmentation du nombre de carbones, n = 3, donne l'alcane propane, CH3-CHdeux-CH3. Maintenant, un nouveau groupe apparaît, CHdeux, appelé méthylène. Quelle que soit la taille de l'alcane linéaire, il n'aura toujours que deux groupes: CH3 et CHdeux.
Longueurs de leurs chaînes
Lorsque n ou le nombre de carbones dans l'alcane linéaire augmente, il y a une constante dans toutes les structures résultantes: le nombre de groupes méthylène augmente. Par exemple, supposons des alcanes linéaires avec n = 4, 5 et 6:
CH3-CHdeux-CHdeux-CH3 (n-butane)
CH3-CHdeux-CHdeux-CHdeux-CH3 (n-pentane)
CH3-CHdeux-CHdeux-CHdeux-CHdeux-CH3 (n-hexane)
Les chaînes deviennent plus longues car elles ajoutent des groupes CH à leurs structuresdeux. Ainsi, un alcane linéaire long ou court diffère par le nombre de CHdeux sépare les deux groupes terminaux CH3. Tous ces alcanes n'ont que deux de ces CH3: au début et à la fin de la chaîne. Si j'avais plus, cela impliquerait la présence de branches.
De même, l'absence totale de groupes CH peut être observée, présente uniquement dans les ramifications ou lorsqu'il y a des groupes substituants liés à l'un des carbones de la chaîne.
La formule développée peut être résumée comme suit: CH3(CHdeux)n-2CH3. Essayez de l'appliquer et de l'illustrer.
Les conformations
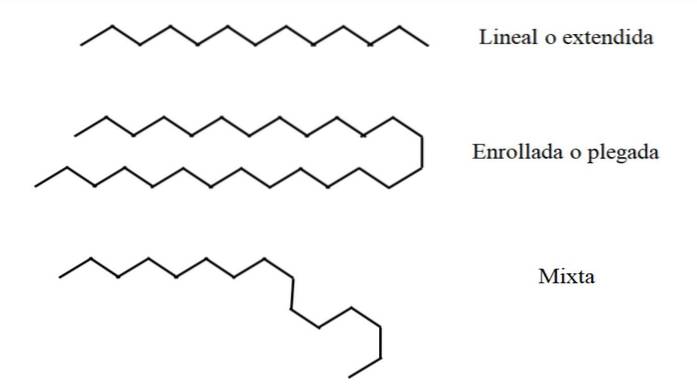
Certains alcanes linéaires peuvent être plus longs ou plus courts que d'autres. Ceci étant le cas, n peut avoir une valeur de 2 a ∞; c'est-à-dire une chaîne composée de groupes CH infinisdeux et deux groupes CH3 terminaux (théoriquement possible). Cependant, toutes les chaînes ne sont pas «logées» de la même manière dans l'espace..
C'est ici qu'apparaissent les conformations structurales des alcanes. Qu'est-ce qu'ils doivent? À la rotabilité des liaisons C-H et à leur flexibilité. Lorsque ces maillons tournent ou tournent autour d'un axe internucléaire, les chaînes commencent à fléchir, se plier ou s'enrouler, s'éloignant de leur caractéristique linéaire d'origine..
Linéaire
Dans l'image du haut, par exemple, une chaîne de treize carbones est représentée en haut qui reste linéaire ou étendue. Cette conformation est idéale, car on suppose que l'environnement moléculaire affecte au minimum la disposition spatiale des atomes de la chaîne. Rien ne la dérange et elle n'a pas besoin de se pencher.
Enroulé ou plié
Au milieu de l'image, la chaîne de 27 carbones subit une perturbation externe. La structure, pour être plus "confortable", fait tourner ses maillons de telle manière qu'elle se replie sur elle-même; comme un long spaghetti.
Des études informatiques ont montré que le nombre maximum de carbones qu'une chaîne linéaire peut avoir est n = 17. A partir de n = 18, il est impossible qu'elle ne commence pas à se plier ou à s'enrouler.
Mixte
Si la chaîne est très longue, il peut y avoir des régions de la chaîne qui restent linéaires tandis que d'autres ont été pliées ou enroulées. De tous, c'est peut-être la conformation la plus proche de la réalité.
Propriétés
Physique
Étant des hydrocarbures, ils sont essentiellement apolaires, et donc hydrophobes. Cela signifie qu'ils ne peuvent pas se mélanger à l'eau. Ils ne sont pas très denses car leurs chaînes laissent trop d'espaces vides entre eux.
De même, leurs états physiques vont de gazeux (pour n < 5), líquidos (para n < 13) o sólidos (para n ≥ 14), y dependen de la longitud de la cadena.
Les interactions
Les molécules d'alcanes linéaires sont apolaires, et donc leurs forces intermoléculaires sont du type de diffusion de Londres. Les chaînes (adoptant probablement une conformation mixte), sont alors attirées par l'action de leurs masses moléculaires et des dipôles induits instantanément de leurs atomes d'hydrogène et de carbone..
C'est pour cette raison que lorsque la chaîne devient plus longue, donc plus lourde, ses points d'ébullition et de fusion augmentent de la même manière..
Stabilité
Plus la chaîne est longue, plus elle est instable. Ils cassent généralement leurs maillons pour faire des chaînes plus petites à partir d'une grande. En fait, ce processus est connu sous le nom de craquer, très utilisé dans le raffinage du pétrole.
Nomenclature
Pour nommer les alcanes linéaires, ajoutez simplement l'indicateur n- avant le nom. Si n = 3, comme pour le propane, il est impossible pour cet alcane de présenter une quelconque ramification:
CH3-CHdeux-CH3
Ce qui n'arrive pas après n = 4, c'est-à-dire avec le n-butane et les autres alcanes:
CH3-CHdeux-CHdeux-CH3
OU ALORS
(CH3)deuxCH-CH3
La deuxième structure correspond à l'isobutane, qui consiste en un isomère structurel du butane. Pour différencier l'un de l'autre, l'indicateur n- entre en jeu. Ainsi, le n-butane fait référence à l'isomère linéaire uniquement, sans branches.
Plus le n est élevé, plus le nombre d'isomères structuraux est élevé et plus il sera important d'utiliser n- pour désigner l'isomère linéaire.
Par exemple, octane, C8H18 (C8H8 × 2 + 2), a jusqu'à treize isomères structuraux, car de nombreuses branches sont possibles. L'isomère linéaire, cependant, est nommé: n-octane, et sa structure est:
CH3-CHdeux-CHdeux-CHdeux-CHdeux-CHdeux-CHdeux-CH3
Exemples
Ils sont mentionnés ci-dessous et pour finir quelques alcanes linéaires:
-Éthane (CdeuxH6): CH3CH3
-Propane (C3H8): CH3CHdeuxCH3
-n-Heptane (C7H16): CH3(CHdeux)5CH3.
- n-Dean (CdixH22): CH3(CHdeux)8CH3.
-n-Hexadécane (C16H3. 4): CH3(CHdeux)14CH3.
-n-Nonadécane (C19H40): CH3(CHdeux)17CH3.
-n-Éicosane (CvingtH42): CH3(CHdeux)18CH3.
- n-Hectane (C100H202): CH3(CHdeux)98CH3.
Les références
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Morrison, R. T. et Boyd, R, N. (1987). Chimie organique. (5e édition). Éditorial Addison-Wesley Interamericana.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (10e édition.). Wiley plus.
- Jonathan M. Goodman. (1997). Quel est l'alcane non ramifié le plus long avec une conformation minimale globale linéaire? J. Chem, Inf. Comput. Sei.1997, 37, 5, 876-878.
- Garcia Nissa. (2019). Que sont les alcanes? Étude. Récupéré de: study.com
- M. Kevin A. Boudreaux. (2019). Alcanes. Récupéré de: angelo.edu
- Liste des alcènes à chaîne droite. [PDF]. Récupéré de: laney.edu
- Helmenstine, Anne Marie, Ph.D. (7 septembre 2018). Nommez les 10 premiers alcanes. Récupéré de: thinkco.com
- Science excentrique. (20 mars 2013). Alcanes à chaîne droite: prédiction des propriétés. Récupéré de: quirkyscience.com
- Wikipédia. (2019). Alcanes supérieurs. Récupéré de: en.wikipedia.org



Personne n'a encore commenté ce post.