
Structure de l'alcool primaire, propriétés, nomenclature, exemples
UNE alcool primaire est celui dans lequel le groupe hydroxyle est lié à un carbone primaire; c'est-à-dire un carbone lié de manière covalente à un autre carbone et à des hydrogènes. Sa formule générale est ROH, plus précisément RCHdeuxOH, car il n'y a qu'un seul groupe alkyle R.
Le groupe R de formule RCHdeuxOH peut être n'importe lequel: une chaîne, un cycle ou des hétéroatomes. Lorsqu'il s'agit d'une chaîne, courte ou longue, on a affaire aux alcools primaires les plus représentatifs; parmi eux, le méthanol et l'éthanol, deux des plus synthétisés au niveau industriel.

Physiquement, ils sont comme les autres alcools, et leur point d'ébullition ou de fusion dépend du degré de leur ramification; mais chimiquement, ce sont les plus réactifs. De plus, son acidité est supérieure à celle des alcools secondaires et tertiaires.
Les alcools primaires subissent des réactions d'oxydation, devenant un grand nombre de composés organiques: esters et éthers, aldéhydes et acides carboxyliques. De même, ils peuvent subir des réactions de déshydratation, se transformant en alcènes ou oléfines.
Index des articles
- 1 Structure d'un alcool primaire
- 2 propriétés
- 2.1 Acidité
- 2.2 Réactions chimiques
- 3 Nomenclature
- 4 exemples
- 5 Références
Structure d'un alcool primaire
Les alcools primaires dérivés d'alcanes linéaires sont les plus représentatifs. Cependant, en réalité toute structure, qu'elle soit linéaire ou ramifiée, peut être classée dans ce type d'alcools tant que le groupe OH est lié à un CHdeux.
Donc, structurellement ils ont tous en commun la présence du groupe -CHdeuxOH, appelé méthylol. Une caractéristique et une conséquence de ce fait est que le groupe OH est moins encombré; c'est-à-dire qu'il peut interagir avec l'environnement sans interférence spatiale d'autres atomes.
De même, un OH moins encombré signifie que l'atome de carbone qui le porte, celui du CHdeux, peut subir des réactions de substitution via un mécanisme SNdeux (bimoléculaire, sans formation de carbocation).
D'autre part, un OH avec une plus grande liberté d'interagir avec le milieu, se traduit par des interactions intermoléculaires plus fortes (par des liaisons hydrogène), qui à leur tour augmentent les points de fusion ou d'ébullition..
La même chose se produit avec sa solubilité dans les solvants polaires, tant que le groupe R n'est pas très hydrophobe..
Propriétés
Acidité
Les alcools primaires sont de tous les plus acides. Pour qu'un alcool se comporte comme un acide de Bronsted, vous devez donner un ion H+ au milieu, c'est-à-dire l'eau, pour devenir un anion alcoxyde:
ROH + HdeuxOU ALORS <=> RO- + H3OU ALORS+
La charge négative de RO-, spécifiquement du RCHdeuxOU ALORS-, est moins repoussé par les électrons des deux liaisons C-H que par les électrons de la liaison C-R.
Le groupe alkyle exerce alors la plus grande répulsion, déstabilisant le RCHdeuxOU ALORS-; mais pas tellement comparé à celui s'il y avait deux ou trois groupes R, comme cela se produit avec les alcools secondaires et tertiaires, respectivement.
Une autre façon d'expliquer l'acidité plus élevée d'un alcool primaire consiste à utiliser la différence d'électronégativité, créant le moment dipolaire: HdeuxCδ+-OU ALORSδ-L'oxygène attire la densité électronique des deux CHdeux à partir de H; la charge partielle positive du carbone repousse un peu celle de l'hydrogène.
Le groupe R transfère une partie de sa densité électronique au CHdeux, ce qui aide à diminuer sa charge partielle positive et avec elle sa répulsion pour la charge d'hydrogène. Plus il y a de groupes R, plus la répulsion est faible, et donc la tendance de H à être libéré comme H+.
pKa
Les alcools primaires sont considérés comme des acides plus faibles que l'eau, à l'exception de l'alcool méthylique, qui est légèrement plus fort. Le pKa de l'alcool méthylique est de 15,2; et le pKa de l'alcool éthylique est de 16,0. Pendant ce temps, le pKa de l'eau est de 15,7.
Cependant, l'eau, qui est considérée comme un acide faible, comme les alcools, peut se lier à H+ se transformer en ion hydronium, H3OU ALORS+; c'est-à-dire qu'il se comporte comme une base.
De la même manière, les alcools primaires peuvent absorber l'hydrogène; en particulier dans certaines de ses propres réactions, par exemple dans sa transformation en alcènes ou oléfines.
Réactions chimiques
Formation d'halogénures d'alkyle
Les alcools réagissent avec les halogénures d'hydrogène pour produire des halogénures d'alkyle. La réactivité des alcools vis-à-vis des halogénures d'hydrogène diminue dans l'ordre suivant:
Alcool tertiaire> alcool secondaire> alcool primaire
ROH + HX => RX + HdeuxOU ALORS
RX est un halogénure d'alkyle primaire (CH3Cl, CH3CHdeuxBr, etc.).
Une autre façon de préparer des halogénures d'alkyle consiste à faire réagir du chlorure de thionyle, un réactif synthétique, avec un alcool primaire qui est converti en chlorure d'alkyle. Chlorure de thionyle (SOCldeux) nécessite la présence de pyridine pour réagir.
CH3(CHdeux)3CHdeuxOH + SOCldeux => CH3(CHdeux)3CHdeuxCl + SOdeux + HCl
Cette réaction correspond à l'halogénation du 1-pentanol pour devenir du 1-chloropentane en présence de pyridine.
Oxydation des alcools primaires
Les alcools peuvent être oxydés en aldéhydes et en acides carboxyliques, selon le réactif. Le chlorochromate de pyridinium (PCC) oxyde l'alcool primaire en aldéhyde, en utilisant du dichlorométhane (CHdeuxCldeux):
CH3(CHdeux)5CHdeuxOH => CH3(CHdeux)5COH
C'est l'oxydation du 1-heptanol en 1-heptanal.
Pendant ce temps, le permanganate de potassium (KMnO4) oxyde d'abord l'alcool en aldéhyde, puis oxyde l'aldéhyde en acide carboxylique. Lorsque le permanganate de potassium est utilisé pour oxyder des alcools, la rupture de la liaison entre les carbones 3 et 4 doit être évitée..
CH3(CHdeux)4CHdeuxOH => CH3(CHdeux)4COOH
C'est l'oxydation du 1-hexanol en acide hexanoïque.
Par ce procédé, il est difficile d'obtenir un aldéhyde, car il est facilement oxydé en un acide carboxylique. Une situation similaire est observée lorsque l'acide chromique est utilisé pour oxyder les alcools.
Formation d'éthers
Les alcools primaires peuvent être convertis en éthers lorsqu'ils sont chauffés en présence d'un catalyseur, généralement de l'acide sulfurique:
2 RCHdeuxOH => RCHdeuxLCOdeuxR + HdeuxOU ALORS
Formation d'esters organiques
La condensation d'un alcool et d'un acide carboxylique, l'estérification de Fisher, catalysée par un acide, produit un ester et de l'eau:
R'OH + RCOOH <=> RCOOR '+ HdeuxOU ALORS
Une réaction bien connue est celle de l'éthanol avec de l'acide acétique, pour donner de l'acétate d'éthyle:
CH3CHdeuxOH + CH3COOH <=> CH3COOHCHdeuxCH3 + HdeuxOU ALORS
L'alcool primaire est le plus sensible aux réactions d'estérification de Fischer.
Déshydratation
A haute température et en milieu acide, généralement de l'acide sulfurique, les alcools se déshydratent pour former des alcènes avec la perte d'une molécule d'eau.
CH3CHdeuxOH => HdeuxC = CHdeux + HdeuxOU ALORS
Il s'agit de la réaction de déshydratation de l'éthanol en éthylène. Une formule générale plus appropriée pour ce type de réaction, spécifiquement pour un alcool primaire, serait:
RCHdeuxOH => R = CHdeux (qui est également égal à RC = CHdeux)
Nomenclature
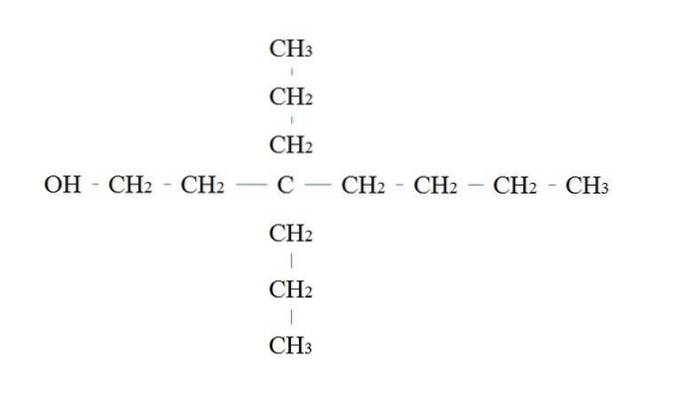
Les règles de dénomination d'un alcool primaire sont les mêmes que pour les autres alcools; à l'exception qu'il n'est parfois pas nécessaire de lister le carbone porteur d'OH.
Dans l'image du haut, il y a une chaîne principale à sept carbones. Le carbone lié à l'OH reçoit le numéro 1, puis il commence à être compté de gauche à droite. Son nom IUPAC est donc: 3,3-diéthylheptanol.
Notez qu'il s'agit d'un exemple d'alcool primaire hautement ramifié.
Exemples
Enfin, certains alcools primaires sont mentionnés sur la base de leur nomenclature traditionnelle et systématique:
-Méthyle, CH3Oh
-Ethyle, CH3CHdeuxOh
-n-propyle, CH3CHdeuxCHdeuxOh
-n-hexyle, CH3CHdeuxCHdeuxCHdeuxCHdeuxCHdeuxOh
Ce sont des dérivés d'alcanes linéaires. D'autres exemples sont:
-2-phényléthanol, C6H5CHdeuxCHdeuxOH (C6H5 = noyau benzénique)
-2-propén-1-ol (alcool allylique), CHdeux= CHCHdeuxOh
-1,2-éthanediol, CHdeuxOHCHdeuxOh
-2-chloroéthanol (éthylène chlorhydrine), ClCHdeuxCHdeuxOh
-2-butén-1-ol (alcool crotylique), CH3CH = CHCHdeuxOh
Les références
- Morrison et R.T. et Boyd, R. N. (1987). Chimie organique. (5ta Édition). Addison-Wesley Iberoamericana
- Carey, F. A. (2008). Chimie organique. (6ta Édition). McGraw-Hill, Interamerica, Editores S.A.
- Mel Science. (2019). Comment se déroule l'oxydation des alcools primaires. Récupéré de: melscience.com
- Société royale de chimie. (2019). Définition: alcools primaires. Récupéré de: rsc.org
- Chriss E. McDonald. (2000). L'oxydation des alcools primaires en esters: trois expériences d'investigation connexes. J. Chem. Educ., 2000, 77 (6), p 750. DOI: 10.1021 / ed077p750



Personne n'a encore commenté ce post.