
Caractéristiques, utilisations et dangers de l'anhydride de carbone
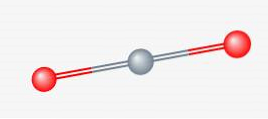
le gaz carbonique c'est un gaz incolore et inodore aux températures et pressions atmosphériques. C'est une molécule composée d'un atome de carbone (C) et de deux atomes d'oxygène (O). Forme de l'acide carbonique (un acide doux) lorsqu'il est dissous dans l'eau. Il est relativement non toxique et ignifuge.
Il est plus lourd que l'air et peut donc provoquer une suffocation lorsqu'il est déplacé. En cas d'exposition prolongée à la chaleur ou au feu, son contenant peut se rompre violemment et expulser des projectiles..
Il est utilisé pour congeler les aliments, pour contrôler les réactions chimiques et comme agent extincteur.
- Formule: CO2
- Numero CAS: 124-38-9
- GNOU: 1013
Structure 2D

Structure 3D
Caractéristiques
Proprietes physiques et chimiques
| Poids moléculaire: | 44,009 g / mol |
| Point de sublimation: | -79 ° C |
| Solubilité dans l'eau, ml / 100 ml à 20 ° C: | 88 |
| Pression de vapeur, kPa à 20 ° C: | 5720 |
| Densité de vapeur relative (air = 1): | 1,5 |
| Coefficient de partage octanol / eau en log Pow: | 0,83 |
Le dioxyde de carbone appartient au groupe des substances chimiquement non réactives (avec l'argon, l'hélium, le krypton, le néon, l'azote, l'hexafluorure de soufre et le xénon, par exemple).
Inflammabilité
Le dioxyde de carbone, comme le groupe des substances chimiquement non réactives, n'est pas inflammable (bien qu'il puisse le devenir à des températures très élevées).
Réactivité
Les substances chimiquement non réactives sont considérées comme non réactives dans des conditions environnementales typiques (bien qu'elles puissent réagir dans des circonstances relativement extrêmes ou sous catalyse). Ils résistent à l'oxydation et à la réduction (sauf dans des conditions extrêmes).
Lorsqu'elles sont en suspension dans du dioxyde de carbone (surtout en présence d'oxydants forts tels que les peroxydes), les poudres de magnésium, lithium, potassium, sodium, zirconium, titane, certains alliages de magnésium et d'aluminium, et l'aluminium chauffé, le chrome et le magnésium sont inflammables et explosifs.
La présence de dioxyde de carbone peut provoquer une décomposition violente dans des solutions d'hydrure d'aluminium dans l'éther, lorsque le résidu est chauffé..
Les dangers découlant de l'utilisation du dioxyde de carbone dans les systèmes de prévention des incendies et d'extinction de volumes confinés d'air et de vapeurs inflammables sont actuellement en cours d'évaluation..
Le risque lié à son utilisation est centré sur le fait que de grandes décharges électrostatiques peuvent être créées qui déclenchent l'explosion..
Le contact du dioxyde de carbone liquide ou solide avec de l'eau très froide peut entraîner une ébullition vigoureuse ou violente du produit et une vaporisation extrêmement rapide en raison des grandes différences de température impliquées..
Si l'eau est chaude, il est possible qu'une explosion de liquide se produise en raison d'une «surchauffe». Les pressions peuvent atteindre des niveaux dangereux si du gaz liquide entre en contact avec de l'eau dans un récipient fermé. De l'acide carbonique faible se forme lors d'une réaction non dangereuse avec l'eau.
Toxicité
Les substances chimiquement non réactives sont considérées comme non toxiques (bien que les substances gazeuses de ce groupe puissent agir comme des asphyxiants).
L'inhalation prolongée de concentrations inférieures ou égales à 5% de dioxyde de carbone, provoque une augmentation de la fréquence respiratoire, des maux de tête et de subtils changements physiologiques.
Cependant, une exposition à des concentrations plus élevées peut entraîner une perte de conscience et la mort..
Les gaz liquides ou froids peuvent provoquer des engelures sur la peau ou les yeux similaires à une brûlure. Le solide peut provoquer des brûlures par contact froid.
Applications
Utilisations de gaz carbonique. Une grande proportion (environ 50%) de tout le dioxyde de carbone récupéré est utilisée au point de production pour fabriquer d'autres produits chimiques d'importance commerciale, principalement l'urée et le méthanol.
Une autre utilisation importante du dioxyde de carbone à proximité de la source du gaz est la récupération assistée du pétrole..
Le reste du dioxyde de carbone généré dans le monde est converti en sa forme liquide ou solide pour être utilisé ailleurs, ou est évacué dans l'atmosphère, car le transport du dioxyde de carbone gazeux n'est pas économiquement réalisable..
Utilisations du dioxyde de carbone solide
La glace sèche était à l'origine la plus importante des deux formes non gazeuses de dioxyde de carbone..
Son utilisation est devenue populaire aux États-Unis au milieu des années 1920 comme réfrigérant pour la conservation des aliments, et dans les années 1930, elle est devenue un facteur majeur de la croissance de l'industrie de la crème glacée..
Après la Seconde Guerre mondiale, des changements dans la conception des compresseurs et la disponibilité d'aciers spéciaux à basse température ont permis de liquéfier le dioxyde de carbone à grande échelle. Par conséquent, le dioxyde de carbone liquide a commencé à remplacer la glace sèche dans de nombreuses applications..
Utilisations du dioxyde de carbone liquide
Les utilisations du dioxyde de carbone liquide sont nombreuses. Dans certains, sa composition chimique est importante et dans d'autres, il ne.
Parmi ceux-ci, nous avons: l'utilisation comme milieu inerte, pour favoriser la croissance des plantes, comme milieu de transfert de chaleur dans les centrales nucléaires, comme réfrigérant, des utilisations basées sur la solubilité du dioxyde de carbone, des utilisations chimiques et d'autres utilisations.
Utilisation comme milieu inerte
Le dioxyde de carbone est utilisé à la place d'une atmosphère atmosphérique lorsque la présence d'air entraînerait des effets indésirables.
Lors de la manipulation et du transport des produits alimentaires, leur oxydation (qui entraîne une perte de goût ou la croissance de bactéries) peut être évitée en utilisant du dioxyde de carbone..
Utiliser pour favoriser la croissance des plantes
Cette technique est appliquée par les producteurs de fruits et légumes, qui introduisent le gaz dans leurs serres pour donner aux plantes des niveaux de dioxyde de carbone plus élevés que ceux normalement présents dans l'air. Les plantes répondent par une augmentation de leur taux d'assimilation du dioxyde de carbone et par une augmentation de la production d'environ 15%.
Utilisation comme fluide caloporteur dans les centrales nucléaires
Le dioxyde de carbone est utilisé dans certains réacteurs nucléaires comme moyen de transfert de chaleur intermédiaire. Transmet la chaleur des processus de fission à la vapeur ou à l'eau bouillante dans les échangeurs de chaleur.
Utiliser comme réfrigérant
Le dioxyde de carbone liquide est largement utilisé pour la congélation des aliments ainsi que pour le stockage et le transport ultérieurs.
Utilisations basées sur la solubilité du dioxyde de carbone
Le dioxyde de carbone a une solubilité modérée dans l'eau, et cette propriété est utilisée dans la production de boissons alcoolisées et non alcoolisées effervescentes. C'était la première application majeure du dioxyde de carbone. L'utilisation du dioxyde de carbone dans l'industrie des aérosols est en constante augmentation.
Utilisations chimiques
Dans la production de moules et noyaux de fonderie, la réaction chimique entre le dioxyde de carbone et la silice est utilisée, qui sert à joindre les grains de sable.
Le salicylate de sodium, l'un des intermédiaires dans la fabrication de l'aspirine, est fabriqué en faisant réagir du dioxyde de carbone avec du phénolate de sodium..
La carbonatation des eaux adoucies est effectuée à l'aide de dioxyde de carbone pour éliminer la précipitation des composés de chaux insolubles.
Le dioxyde de carbone est également utilisé dans la production de carbonate de plomb basique, de carbonates de sodium, de potassium et d'ammonium et d'hydrogénocarbonate..
Il est utilisé comme agent neutralisant dans les opérations de mercerisation dans l'industrie textile car il est plus pratique à utiliser que l'acide sulfurique.
Autres utilisations
Le dioxyde de carbone liquide est utilisé dans un processus d'extraction du charbon, il peut être utilisé pour isoler certains arômes et parfums, l'anesthésie des animaux avant l'abattage, le cryo-marquage des animaux, la génération de brouillard pour les productions théâtrales, des exemples de telles utilisations sont le gel de tumeurs bénignes et les verrues, les lasers, la production d'additifs pour huiles lubrifiantes, le traitement du tabac et l'assainissement avant l'enterrement..
Effets cliniques
L'exposition aux asphyxiants se produit principalement en milieu industriel, parfois dans le contexte de catastrophes naturelles ou industrielles.
Les asphyxiants simples comprennent, mais sans s'y limiter, le dioxyde de carbone (CO2), l'hélium (He) et les hydrocarbures gazeux (méthane (CH4), éthane (C2H6), propane (C3H8) et butane (C4H10)).
Ils agissent en déplaçant l'oxygène de l'atmosphère, entraînant une diminution de la pression partielle de l'oxygène alvéolaire et, par conséquent, une hypoxémie.
L'hypoxémie produit une image de l'euphorie initiale, ce qui peut compromettre la capacité du patient à s'échapper de l'environnement toxique.
Un dysfonctionnement du SNC et un métabolisme anaérobie indiquent une toxicité sévère.
Intoxication légère à modérée
La saturation en oxygène peut être inférieure à 90%, même chez les patients asymptomatiques ou légèrement symptomatiques. Il se produit avec une diminution de la vision nocturne, des maux de tête, des nausées, une augmentation de la respiration et du pouls compensatoires.
Intoxication sévère
La saturation en oxygène peut être de 80% ou moins. Il y a diminution de la vigilance, somnolence, étourdissements, fatigue, euphorie, perte de mémoire, diminution de l'acuité visuelle, cyanose, perte de conscience, dysrythmies, ischémie myocardique, œdème pulmonaire, convulsions et décès.
Sécurité et risques
Mentions de danger du Système général harmonisé de classification et d'étiquetage des produits chimiques (SGH).
Le Système général harmonisé de classification et d'étiquetage des produits chimiques (SGH) est un système internationalement reconnu, créé par les Nations Unies et conçu pour remplacer les diverses normes de classification et d'étiquetage utilisées dans différents pays en utilisant des critères cohérents au niveau mondial (Nations Unies, 2015 ).
Les classes de danger (et leur chapitre correspondant du SGH), les normes de classification et d'étiquetage et les recommandations pour le dioxyde de carbone sont les suivantes (Agence européenne des produits chimiques, 2017; Nations Unies, 2015; PubChem, 2017):


Les références
- D'après Jacek FH, (2006). Carbon-dioxide-3D-vdW [image] Récupéré de wikipedia.org.
- Anon, (2017). [image] Récupérée de nih.gov.
- Agence européenne des produits chimiques (ECHA). (2017). Résumé de la classification et de l'étiquetage.
- Classification et étiquetage notifiés. Gaz carbonique. Récupéré le 16 janvier 2017.
- Banque de données sur les substances dangereuses (HSDB). TOXNET. (2017). Gaz carbonique. Bethesda, MD, UE: Bibliothèque nationale de médecine.
- Institut national pour la sécurité au travail (INSHT). (2010). Cartes internationales de sécurité chimique Dioxyde de carbone. Ministère de l’emploi et de la sécurité. Madrid. C'EST.
- Nations Unies (2015). Système général harmonisé de classification et d'étiquetage des produits chimiques (SGH), sixième édition révisée. New York, UE: Publication des Nations Unies.
- Centre national d'information sur la biotechnologie. Base de données des composés PubChem. (2017). Gaz carbonique. Bethesda, MD, UE: Bibliothèque nationale de médecine.
- Administration nationale des océans et de l'atmosphère (NOAA). Produits chimiques CAMEO. (2017). Fiche technique du groupe réactif. Non chimiquement réactif. Silver Spring, MD. UE.
- Administration nationale des océans et de l'atmosphère (NOAA). Produits chimiques CAMEO. (2017). Fiche technique chimique. Gaz carbonique. Silver Spring, MD. UE.
- Topham, S., Bazzanella, A., Schiebahn, S., Luhr, S., Zhao, L., Otto, A. et Stolten, D. (2000). Gaz carbonique. Dans l'Encyclopédie d'Ullmann de chimie industrielle. Wiley-VCH Verlag GmbH & Co. KGaA.
- Wikipédia. (2017). Gaz carbonique. Extrait le 17 janvier 2017 de wikipedia.org.


Personne n'a encore commenté ce post.