
Structure du bleu de bromothymol, propriétés, préparation, utilisations
le bleu de bromothymol C'est un colorant sensible au pH de son environnement et a été utilisé comme indicateur dans de nombreuses réactions de laboratoire. Un indicateur est un colorant organique dont la couleur dépend de la concentration de l'ion H.3OU ALORS+ ou le pH du milieu. Par la couleur qu'il affiche, l'indicateur peut indiquer l'acidité ou la basicité de la solution.
Le bleu de bromothymol a une échelle d'indication active entre pH 6,0 et 7,6. A un pH du milieu inférieur à 6,5, il présente une coloration jaune. Lorsque le pH du milieu varie entre 6,5 et 7,6, il acquiert une couleur verte. À pH supérieur à 7,6, sa couleur est bleue.

Cette caractéristique rend cet indicateur très utile, car il peut être utilisé dans une échelle de pH proche de la neutralité; précisément là où se produisent les processus physiologiques.
L'ionisation du bleu de bromothymol en solution aqueuse peut être décrite comme suit:
HIn (couleur jaune) + HdeuxOU ALORS <=> Dans- (couleur bleue) + H3OU ALORS+
Lorsque l'indicateur est protoné (HIn), il acquiert une couleur jaune; alors que si l'indicateur déprotoné (In-) devient bleu.
Index des articles
- 1 Structure chimique
- 1.1 changements de pH
- 2 propriétés
- 2.1 Nom chimique
- 2.2 Formule moléculaire
- 2.3 Poids moléculaire
- 2.4 Apparence physique
- 2.5 Caractéristique chimique
- 2.6 Constante de dissociation ionique (Ka)
- 2.7 Plage d'indication active
- 2.8 Densité
- 2.9 Point de fusion
- 2.10 Point d'ébullition
- 2.11 Solubilité
- 2.12 Stabilité
- 2.13 Absorption lumineuse
- 3 Utilisations et applications
- 3.1 Dans les études métaboliques
- 3.2 En obstétrique
- 3.3 Autres utilisations
- 4 Préparation
- 5 Références
Structure chimique
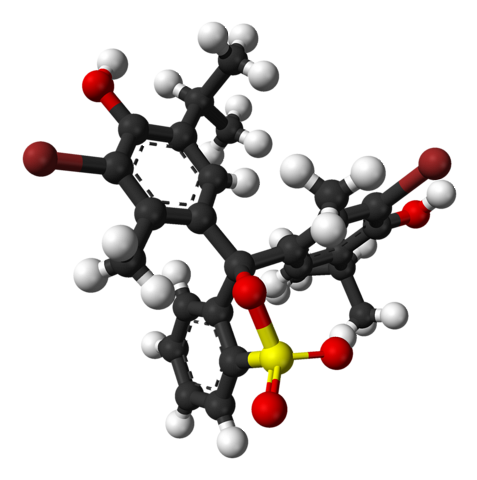
L'image du haut représente la structure du bleu de bromothymol avec un modèle de barre et de sphère à un pH inférieur à 7,1. Les barres brunes correspondent aux atomes de brome, deux au total.
Chacun des trois cycles aromatiques compose, avec les groupes méthyle, CH3, et tertbutyle, le groupe thymol; et ayant lié un Br, de là surgit la raison pour laquelle il est appelé `` bromothymol ''.
En bas est montré le groupe sulfonate, R-SO3-, avec des sphères rouges et une jaune. Ce groupe peut être lié par un atome O au carbone central qui relie les trois cycles aromatiques.
Changements de PH
Bien que cette structure moléculaire ne change pas radicalement avec un pH acide ou basique, ses états électroniques sont modifiés, reflétés par des changements dans la couleur des solutions.
En dessous de pH 7, l'indicateur est de couleur jaune et adopte la structure de l'image; mais si le pH devient basique, les groupes -OH se déprotonent et une double liaison C = O peut se former.
En conséquence, le système conjugué de la molécule (celui de toutes ses doubles liaisons résonantes) change suffisamment pour que les électrons n'absorbent plus les mêmes photons, et la solution vire du jaune au bleuâtre..
Si, en revanche, le pH est bien inférieur à 7, la couleur de l'indicateur passe du jaune au rouge. Ici, le changement du système conjugué est dû à la protonation des groupes -OH en -OHdeux+. -
Dans les environnements acides et basiques, la molécule perd de sa stabilité, absorbant des photons d'énergie plus faible pour permettre les transitions électroniques responsables des couleurs perçues par les spectateurs..
Et qu'en est-il de la couleur verte de l'image principale? Lorsque le pH approche 7,1, une petite partie des molécules perd des protons, dégageant une couleur bleue qui, mélangée avec du jaune, donne la couleur verte..
Propriétés
Nom chimique
Bleu de bromothymol ou 3,3'-dibromothymolsulfonaphtaléine.
Formule moléculaire
C27H28BrdeuxOU ALORS5S.
Poids moléculaire
624,384 g / mol.
Aspect physique
Poudre solide d'une couleur allant du rose au violet.
Caractéristique chimique
Il agit comme un acide faible en solution. Lorsqu'il est protoné dans un milieu acide, il acquiert une couleur jaune, à pH neutre, il est vert, et lorsqu'il est déprotoné à un pH alcalin, il est bleu.
Constante de dissociation ionique (Ka)
7,9 x 10-8.
Plage d'indication active
pH 6,0 à 7,6. Cela est dû à la présence d'atomes de brome qui agissent pour extraire les électrons et de deux groupes donneurs d'électrons modérés (substituants alkyle).
Densité
1,25 g / cm3.
Point de fusion
202 ºC (396 º F).
Point d'ébullition
184,9 ºC.
Solubilité
Il est peu soluble dans l'eau et l'huile. De même, il est peu soluble dans les solvants non polaires tels que le benzène, le toluène et le xylène, et pratiquement insoluble dans l'éther de pétrole. Il est soluble dans les solutions aqueuses alcalines et dans l'alcool.
Stabilité
Il est stable à température ambiante et incompatible avec les agents oxydants forts.
Absorption lumineuse
La forme protonée a son absorption maximale à une longueur d'onde (λ) de 427 nm, transmettant ainsi la lumière jaune dans les solutions acides et la forme déprotonée a une absorption maximale à une longueur d'onde (λ) de 602 nm, transmettant une lumière bleue.à pH alcalin.
Utilisations et applications
Dans les études métaboliques
Le bleu de bromothymol est utilisé dans de nombreux procédés dans lesquels le dioxyde de carbone (COdeux), avec la génération conséquente d'acide carbonique (HdeuxCO3), qui acidifie le milieu; mis en évidence par un changement de coloration du bleu de bromothymol.
Si une personne fait de l'exercice physique et est connectée à un tube qui, à son tour, est connecté à un récipient contenant une solution de bleu de bromothymol, le phénomène suivant sera observé: en raison de l'augmentation de l'activité physique et du métabolisme, il y aura un augmentation de la production de COdeux.
Le COdeux réagira avec l'eau, produisant de l'acide carbonique, HdeuxCO3, qui se dissocie ensuite en libérant l'ion H+ et acidifier le milieu. En conséquence, le bleu de bromothymol acquiert une couleur jaune, soulignant l'acidité du milieu..
En obstétrique
Le bleu de bromothymol est utilisé en obstétrique pour montrer une rupture précoce des membranes. Le liquide amniotique a normalement un pH supérieur à 7,7, de sorte que le bleu de bromothymol vire au bleu lorsqu'il entre en contact avec le liquide s'échappant de l'amnios..
Le pH vaginal est généralement acide, le bleu de bromothymol a donc une teinte jaune. Le changement de sa couleur en bleu met en évidence la présence de liquide amniotique dans la région vaginale.
Autres utilisations
Le bleu de bromothymol a également une application dans les équipements et fonctions suivants:
-Capteurs optiques
-Systèmes de détection de combustion de gaz
-Dans la fabrication de peintures, jouets, produits de nettoyage, détergents et textiles
-Capteurs de fraîcheur des aliments
-Comme poignée pour le riz frais et rassis
-Dans la détection de micro-organismes.
Il est également utilisé dans l'analyse de la croissance bactérienne, les médicaments psychoactifs et les matériaux dentaires..
préparation
100 mg de bleu de bromothymol sont dissous dans 100 mL d'alcool dilué et filtrés si nécessaire. Il est également préparé comme suit: 50 mg de bleu de bromothymol sont dissous dans un mélange de 4 mL d'hydroxyde de sodium 0,02 N et 20 mL d'alcool, jusqu'à 100 mL avec de l'eau.
Les références
- Wikipédia. (2018). Bleu de bromothymol. Récupéré de: en.wikipedia.org
- Foist L. (2018). Bleu de bromothymol: définition, utilisations & formule. Étude. Récupéré de: study.com
- La société scientifique. (2018). Indicateur de pH bleu de bromothymol, 1 oz. Récupéré de: sciencecompany.com
- Détermination spectrophotométrique du pK de l'indicateur bleu de bromothymol. Récupéré de: fch.upol.cz
- PubChem. (2018). Bleu de bromothymol. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Société royale de chimie. (2015). Bleu de bromothymol. ChemSpider. Récupéré de: chemspider.com
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.


Personne n'a encore commenté ce post.