
Formules, caractéristiques et utilisations de l'acide hyposulfure
le acide hyposulfure ou l'acide dithioneux est inconnu, instable sous forme pure, n'a pas d'existence indépendante et n'a pas été détecté en solution aqueuse.
Théoriquement, ce serait un acide relativement faible, comparable à l'acide sulfureux, H2SO3. Seuls ses sels sont connus, les dithionites, qui sont des agents réducteurs stables et puissants. Le sel de sodium de l'acide dithionique est le dithionite de sodium.

- Formules
| acide dithioneux | anion dithionite | dithionite de sodium | |
| Formules | H2S2O4 | S2O42− | Na2S2O4 |
- CAS: 20196-46-7 acide hyposulfure (ou dithioneux)
- CAS: 14844-07-6 acide hyposulfure (ou ion dithioneux)
- CAS: 7775-14-6 dithionite de sodium (sel de sodium de l'acide dithioneux)
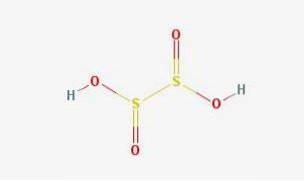
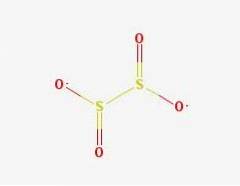
Structure 2D
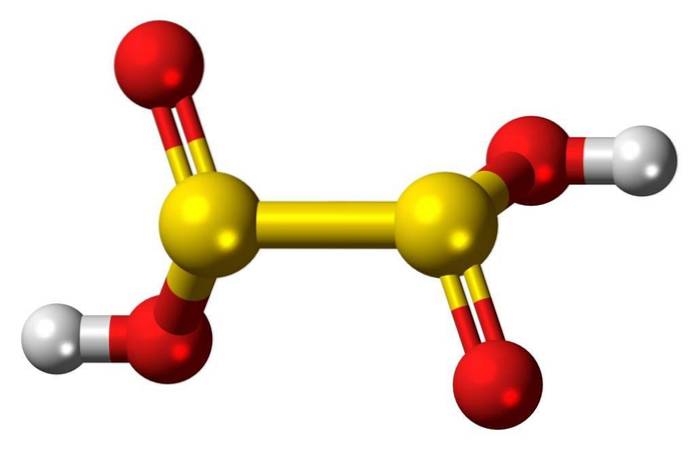
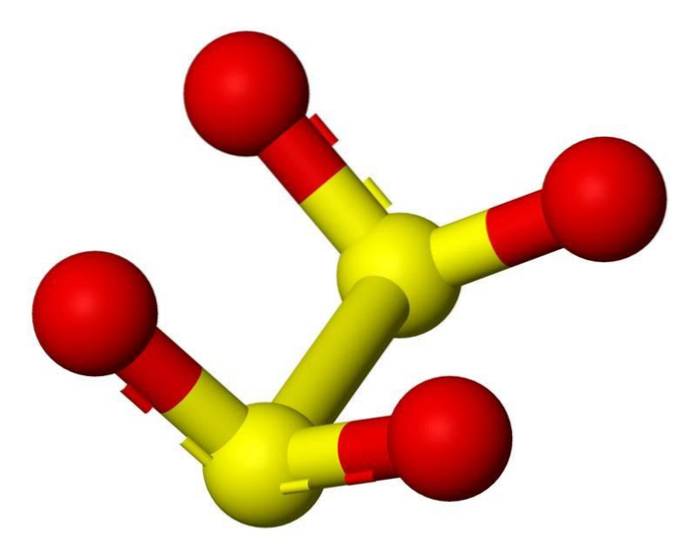
Structure 3D
Caractéristiques
Proprietes physiques et chimiques
| acide dithioneux | anion dithionite | dithionite de sodium | |
| Apparence: | . | . | Poudre cristalline blanche à blanc cassé |
| . | . | Flocons de citron légers | |
| Odeur: | . | . | Légère odeur de soufre |
| Poids moléculaire: | 130,132 g / mol | 128,116 g / mol | 174,096 g / mol |
| Point d'ébullition: | . | . | Il se décompose |
| Point de fusion: | . | . | 52 ° C |
| Densité: | . | . | 2,38 g / cm3 (anhydre) |
| Solubilité dans l'eau | . | . | 18,2 g / 100 ml (anhydre, 20 ° C) |
L'acide hyposulfureux est un oxo-acide sulfureux de formule chimique H2S2O4.
Les oxoacides de soufre sont des composés chimiques contenant du soufre, de l'oxygène et de l'hydrogène. Cependant, certains d'entre eux ne sont connus que pour leurs sels (tels que l'acide hyposulfure, l'acide dithionique, l'acide disulfure et l'acide sulfureux).
Parmi les caractéristiques structurelles des oxoacides qui ont été caractérisées, nous avons:
- Soufre tétraédrique lorsqu'il est coordonné avec l'oxygène
- Ponts et atomes d'oxygène terminaux
- Groupes peroxo terminaux
- Bornes S = S
- Chaînes de (-S-) n
L'acide sulfurique est l'oxoacide de soufre le plus connu et le plus important sur le plan industriel.
L'anion dithionite ([S2O4] 2-) est un oxoanion (un ion de formule générique AXOY z-) de soufre formellement dérivé de l'acide dithionique.
Les ions dithionite subissent une hydrolyse acide et alcaline en thiosulfate et bisulfite, et sulfite et sulfure, respectivement:
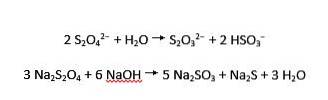
Le sel de sodium de l'acide dithioneux est le dithionite de sodium (également connu sous le nom d'hydrosulfite de sodium).
Le dithionite de sodium est une poudre cristalline blanchâtre à jaune clair qui a une odeur similaire au dioxyde de soufre..
Il se réchauffe spontanément au contact de l'air et de l'humidité. Cette chaleur peut suffire à enflammer les matériaux combustibles environnants..
En cas d'exposition prolongée au feu ou à une chaleur intense, les conteneurs de ce matériau peuvent se rompre violemment..
Il est utilisé comme réducteur et comme agent de blanchiment. Il est utilisé et pour le blanchiment de la pâte à papier et dans la teinture. Il est également utilisé pour réduire le groupe nitro en un groupe amino dans les réactions organiques..
Bien que stable dans la plupart des conditions, il se décompose dans l'eau chaude et les solutions acides.
Il peut être obtenu à partir de bisulfite de sodium par la réaction suivante:
2 NaHSO3 + Zn → Na2S2O4 + Zn (OH) ²
Réactions de l'air et de l'eau
Le dithionite de sodium est un solide combustible qui se décompose lentement au contact de l'eau ou de la vapeur d'eau, formant des thiosulfates et des bisulfites..
Cette réaction produit de la chaleur qui peut accélérer davantage la réaction ou provoquer la combustion des matériaux environnants. Si le mélange est confiné, la réaction de décomposition peut entraîner une mise sous pression du récipient, qui peut se rompre avec force. Restant dans l'air, il s'oxyde lentement, générant des gaz toxiques de dioxyde de soufre.
Danger d'incendie
Le dithionite de sodium est un matériau inflammable et combustible. Peut s'enflammer au contact de l'air humide ou de l'humidité. Il peut brûler rapidement avec un effet de flare. Peut réagir vigoureusement ou explosivement au contact de l'eau.
Peut se décomposer de manière explosive lorsqu'il est chauffé ou impliqué dans un incendie. Il peut être rallumé après l'extinction du feu. Le ruissellement peut créer un risque d'incendie ou d'explosion. Les contenants peuvent exploser lorsqu'ils sont chauffés.
Danger pour la santé
Au contact du feu, le dithionite de sodium produira des gaz irritants, corrosifs et / ou toxiques. L'inhalation de produits de décomposition peut provoquer des blessures graves ou la mort. Le contact avec la substance peut provoquer de graves brûlures de la peau et des yeux. Le ruissellement du contrôle des incendies peut causer de la pollution.
Applications
L'ion dithionite est utilisé, souvent en conjonction avec un agent complexant (par exemple l'acide citrique), pour réduire l'oxyhydroxyde de fer (III) en composés de fer (II) solubles et éliminer les phases minérales amorphes contenant du fer (III) dans l'analyse du sol (extraction sélective ).
La dithionite augmente la solubilité du fer. Grâce à la forte affinité de l'ion dithionite pour les cations métalliques bivalents et trivalents, il est utilisé comme agent chélatant..
La décomposition du dithionite produit des espèces réduites de soufre qui peuvent être très agressives pour la corrosion de l'acier et de l'acier inoxydable..
Parmi les applications du dithionite de sodium, nous avons:
Dans l'industrie
Ce composé est un sel soluble dans l'eau et peut être utilisé comme agent réducteur dans des solutions aqueuses. Il est utilisé tel quel dans certains procédés de teinture industriels, principalement ceux impliquant des colorants au soufre et des colorants de cuve, dans lesquels un colorant insoluble dans l'eau peut être réduit en un sel de métal alcalin soluble dans l'eau (par exemple, le colorant indigo).
Les propriétés réductrices du dithionite de sodium éliminent également l'excès de colorant, l'oxyde résiduel et les pigments indésirables, améliorant ainsi la qualité globale de la couleur..
Le dithionite de sodium peut également être utilisé pour le traitement de l'eau, la purification des gaz, le nettoyage et l'extraction. Il peut également être utilisé dans des procédés industriels comme agent sulfonant ou source d'ions sodium.
En plus de l'industrie textile, ce composé est utilisé dans les industries liées au cuir, à l'alimentation, aux polymères, à la photographie et bien d'autres. Également utilisé comme agent de blanchiment dans les réactions organiques.
Dans les sciences biologiques
Le dithionite de sodium est souvent utilisé dans les expériences de physiologie comme moyen de réduire le potentiel redox des solutions..
En sciences géologiques
Le dithionite de sodium est souvent utilisé dans les expériences de chimie du sol pour déterminer la quantité de fer qui n'est pas incorporée dans les minéraux silicatés primaires..
Sécurité et risques
Mentions de danger du Système général harmonisé de classification et d'étiquetage des produits chimiques (SGH)
Le Système général harmonisé de classification et d'étiquetage des produits chimiques (SGH) est un système internationalement reconnu, créé par les Nations Unies et conçu pour remplacer les diverses normes de classification et d'étiquetage utilisées dans différents pays en utilisant des critères cohérents à l'échelle mondiale..
Les classes de danger (et leur chapitre GHS correspondant), les normes de classification et d'étiquetage et les recommandations pour le dithionite de sodium sont les suivantes (Agence européenne des produits chimiques, 2017; Nations Unies, 2015; PubChem, 2017):



Les références
- Benjah-bmm27, (2006). Un modèle boule et bâton de l'ion dithionite [image] Récupéré de wikipedia.org.
- Drozdova, Y., Steudel, R., Hertwig, R. H., Koch, W., et Steiger, T. (1998). Structures et énergies de divers isomères de l'acide dithioneux, H2S2O4, et de son anion HS2O4-1. Le Journal of Physical Chemistry A, 102 (6), 990-996. Récupéré de: mycrandall.ca
- Agence européenne des produits chimiques (ECHA). (2017). Résumé de la classification et de l'étiquetage. Classification harmonisée - Annexe VI du règlement (CE) n ° 1272/2008 (règlement CLP). Dithionite de sodium, hydrosulfite de sodium. Extrait le 2 février 2017 de: echa.europa.eu
- Jynto (entretien), (2011). Dithionous-acid-3D-balls [image] Récupéré de: https://en.wikipedia.org/wiki/Dithionous_acid#/media/File:Dithionous-acid-3D-balls.png
- LHcheM, (2012). Échantillon de dithionite de sodium [image] Récupéré de: wikipedia.org.
- Mills, B. (2009). Boules de dithionite de sodium-xtal-1992-3D [image] Récupéré de: wikipedia.org.
- Nations Unies (2015). Système général harmonisé de classification et d'étiquetage des produits chimiques (SGH), sixième édition révisée. New York, UE: Publication des Nations Unies. Récupéré de: unece.orgl
- Centre national d'information sur la biotechnologie. Base de données des composés PubChem. (2017). Dithionite. Bethesda, MD, UE: Bibliothèque nationale de médecine. Récupéré de: pubchem.ncbi.nlm.nih.gov.
- Centre national d'information sur la biotechnologie. Base de données des composés PubChem. (2017). Acide dithioneux. Bethesda, MD, UE: Bibliothèque nationale de médecine. Récupéré de: nih.gov.
- Centre national d'information sur la biotechnologie. Base de données des composés PubChem. (2017). Dithionite de sodium. Bethesda, MD, UE: Bibliothèque nationale de médecine. Récupéré de: nih.gov.
- Administration nationale des océans et de l'atmosphère (NOAA). Produits chimiques CAMEO. (2017). Fiche technique chimique. Dithionite de sodium. Silver Spring, MD. UE; Récupéré de: cameochemicals.noaa.gov
- PubChem, (2016). Dithionite [image] Récupéré de: nih.gov.
- PubChem, (2016). Dithionite [image] Récupéré de: nih.gov.
- PubChem, (2016). Acide dithioneux [image] Récupéré de: nih.gov.
- Wikipédia. (2017). Dithionite. Extrait le 2 février 2017 de: wikipedia.org.
- Wikipédia. (2017). Dithionous_acid. Extrait le 2 février 2017 de: wikipedia.org.
- Wikipédia. (2017). Oxyanion. Extrait le 2 février 2017 de: wikipedia.org.
- Wikipédia. (2017). Dithionite de sodium. Extrait le 2 février 2017 de: wikipedia.org.
- Wikipédia. (2017). Oxoacide de soufre. Extrait le 2 février 2017 de: wikipedia.org.



Personne n'a encore commenté ce post.