
Raison d'être du Biuret, réactifs, mode opératoire, utilisations

le Biuret est un réactif utilisé pour la détermination des protéines à chaîne longue et à chaîne courte. Il est particulièrement utilisé dans le domaine de la chimie analytique et des analyses d'urine pour étudier la concentration de protéines totales dans le sérum, le plasma et l'urine..
Les valeurs protéiques peuvent être augmentées ou diminuées dans certaines pathologies. Les symptômes d'hypoprotéinémie surviennent généralement chez les patients atteints d'insuffisance rénale, chez les patients souffrant de malnutrition et chez les patients souffrant d'infections chroniques..
Alors que l'hyperprotéinémie est observée dans des pathologies telles que le myélome multiple, le lupus érythémateux systémique, l'endocardite bactérienne, la méningite bactérienne, la macroglobulinémie de Waldenström, entre autres..
En revanche, la présence de protéines dans l'urine est due à la filtration de l'albumine par le rein. C'est un comportement pathologique qui doit être étudié.
En ce sens, le Biuret est très utile, car il permet de quantifier la présence de protéines dans le sérum, le plasma, l'urine, parmi de nombreux autres échantillons..
Même Biuret peut être utilisé pour étudier la présence et la concentration de protéines dans des échantillons mal explorés ou des échantillons de composition inconnue. Par conséquent, il est largement utilisé dans le domaine de la recherche.
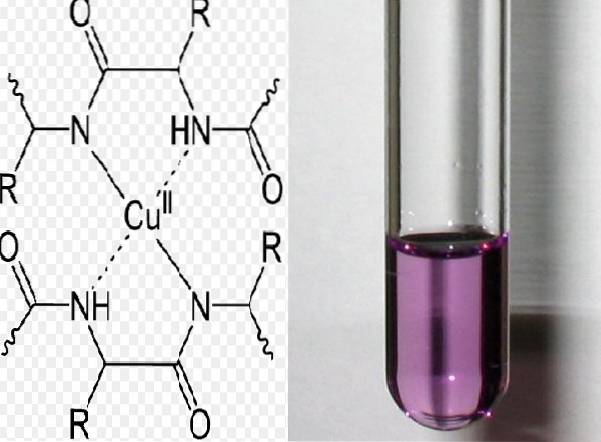
Le test Biuret est basé sur la détection de liaisons peptidiques. Le test a lieu en milieu alcalin. L'échantillon doit contenir au moins deux liaisons peptidiques pour qu'un complexe violet-violet se forme. Le complexe est formé par l'union des liaisons et de l'ion cuivre.
Index des articles
- 1 Justification
- 2 réactifs
- 2.1 Stabilité du réactif Biuret
- 3 Procédure
- 3.1 Technique
- 3.2 Courbe d'étalonnage
- 4 Interférences
- 4.1 Substances qui interfèrent avec le test Biuret
- 4.2 Substances qui n'interfèrent pas avec le test Biuret
- 5 avantages
- 6 Inconvénients
- 7 utilisations
- 7.1 Pathologies qui surviennent avec une augmentation ou une diminution des protéines
- 7.2 Échantillons cliniques
- 7.3 Échantillons non cliniques
- 8 Références
Base
Le réactif de Biuret est composé d'hydroxyde de potassium, de sulfate cuivrique et de tartrate de sodium et de potassium. L'hydroxyde de sodium est utilisé pour alcaliniser le milieu, car cette condition est essentielle pour que la réaction ait lieu.
Les substances qui réagissent avec les protéines est le sulfate de cuivre, tandis que le tartrate de sodium a pour fonction de ne pas permettre la formation d'hydroxyde de cuivre, qui a tendance à précipiter et interfère avec la réaction..
Si des substances avec des liaisons peptidiques (polypeptides ou protéines) sont trouvées dans l'échantillon, le test sera positif.
Une réaction est interprétée comme positive lorsque la solution devient violette. La couleur est produite par la formation d'un complexe entre au moins deux liaisons peptidiques qui ont le groupe CO-NH et les cations cuivriques.
Le complexe violet peut être formé de deux manières: l'une est par la perte de protons des groupes amide qui se lient au métal (dépronotation), et l'autre par l'union des électrons d'oxygène et d'azote qui sont libres et se lient au cuivre..
Cette réaction peut varier en intensité et en couleur selon le type de protéine..
Le test peut être effectué de manière qualitative ou quantitative. Dans la forme qualitative, il est rapporté comme positif ou négatif. Alors que sous forme quantitative, la concentration peut être mesurée par la méthode spectrophotométrique.
La réaction est lue entre 540-560 nm. L'intensité de la couleur est directement proportionnelle à la concentration de liaisons peptidiques dans l'échantillon..
Réactifs
-Hydroxyde de sodium (NaOH) 20%
-1% de sulfate de cuivre pentahydraté (CuSO4. 5HdeuxOU ALORS)
-Tartrate de sodium et potassium tétrahydraté (KNaC4H4OU ALORS64HdeuxOU ALORS)
Stabilité des réactifs Biuret
-Il doit être conservé au réfrigérateur.
Traiter
Technique
-Placer 100 µl de l'échantillon ou du standard à analyser dans un tube à essai.
-Ajouter 2 ml d'hydroxyde de sodium.
-Mélangez très bien.
-Ajouter 5 ml de réactif Biuret.
-Mélanger et laisser reposer 25 minutes à température ambiante, couvrir et protéger de la lumière.
-Observer la formation ou non de la couleur et mesurer par spectrophotométrie.
Courbe d'étalonnage
L'albumine de sérum bovin peut être utilisée comme étalon pour réaliser la courbe d'étalonnage. Différentes concentrations en sont préparées. Par exemple 25, 50, 75, 100, 125 et 150%.
La réaction est mise en place avec toutes ces concentrations connues et l'absorbance est lue à une longueur d'onde de 540 nm. Avec les données des concentrations connues et les lectures d'absorbance, la courbe d'étalonnage est faite.
Dans chaque détermination ou lot d'échantillons traités, il est recommandé de monter un étalon. L'albumine de sérum bovin 0,1-2 mg / ml peut être utilisée comme standard d'étalonnage..
Les mesures sont effectuées sur un spectrophotomètre à 540 nm.
La linéarité est satisfaite jusqu'à une concentration de 12 g / dl.
Ingérence
Substances qui interfèrent avec le test Biuret
Bien que ce ne soit pas très fréquent, il convient de noter que certaines substances peuvent interférer lors de l'exécution de ce test. Par exemple, la présence d'ammoniaque peut inhiber la formation de couleur.
De même, d'autres substances pourraient absorber à la même longueur d'onde, comme certains pigments..
D'autre part, des interférences peuvent être générées lorsqu'une substance autre que la liaison peptidique forme un complexe avec le sel cuivrique. Exemple: certains glucides et certains lipides.
Si l'échantillon à analyser présente un certain type de précipité, il doit être filtré ou centrifugé avant de monter le test..
Substances qui n'interfèrent pas avec le test Biuret
Le test n'est pas affecté par la présence de:
-Bilirubine jusqu'à une concentration de 20 mg / dl.
-Hémoglobine jusqu'à une concentration de 750 mg / dl.
-Dextran jusqu'à une concentration de 30 g / L.
-Triglycérides jusqu'à une concentration de 4000 mg / dl.
avantage
-C'est une méthode simple à exécuter.
-C'est un test économique.
-A une spécificité élevée pour les protéines.
-Peu d'interférences.
Désavantages
Il a une faible sensibilité pour détecter de faibles quantités de protéines. Les travaux menés par Fuentes et collaborateurs affirment que la méthode de test Biuret a une limite de détection de 1 mg / ml de protéine et une limite de quantification de 3 mg / ml.
Cependant, d'autres recherches menées à l'Université d'Amazonie rapportent des valeurs bien inférieures. La limite de détection rapportée par l'étude est de 0,020 mg / ml et la limite de quantification est de 1,33 mg / ml..
Applications
Le réactif ou test Biuret est utilisé pour la détermination des protéines dans les échantillons cliniques et non cliniques dans les laboratoires de routine et de recherche.
Pathologies qui surviennent avec une augmentation ou une diminution de protéine
Dans de nombreuses pathologies, il est important de déterminer la concentration de protéines totales dans les échantillons cliniques, qui peut être élevée ou faible.
Ils sont élevés en:
-Le myélome multiple,
-Le lupus érythémateux disséminé,
-Endocardite bactérienne,
-Méningite bactérienne,
Macroglobulinémie de Waldenström, entre autres.
Il est diminué en:
-Insuffisance rénale,
-Les personnes souffrant de malnutrition sévère,
-Les patients atteints d'infections chroniques, entre autres.
Échantillons cliniques
Les échantillons cliniques les plus courants sont le sérum, le plasma et l'urine. La valeur normale des protéines dans le sérum ou le plasma est de 6,0 à 8,8 gr / dl.
La concentration de protéines dans l'urine chez l'adulte ne dépasse pas le chiffre de 150 mg / 24 heures.
Valeur normale du rapport protéines urinaires / créatinine urinaire
Nourrissons: < a 0,50 mg
Enfants de 2 ans et plus: indice: 0,20 mg
Adultes: < 0,2 mg
Échantillons non cliniques
La réaction Biuret peut être utilisée pour de nombreux types d'échantillons non cliniques, tels que les produits laitiers, les antivenins ou toute substance inconnue pour laquelle vous souhaitez rechercher la présence de protéines..
Les références
- Vázquez J, Guerra L, Quintana J, Ramírez J, Fernando Ry Vázquez Y. (2014). Caractérisation physico-chimique et teneur en protéines d'extraits fluides de l'huître de mangrove (Crassostrearizophorae). Journal cubain de chimie, 26 (1), 66-74. Extrait le 26 juin 2019 de http: //scielo.sld
- Chaparro S, Lara A, Sandoval A, Sosa S, Martínez J, Gil J.Caractérisation fonctionnelle de l'amande à partir de graines de mangue (Mangifera indica L.) Magazine Science et Développement. 2015; 6 (1): 67-75
- «Biuret». Wikipedia, l'encyclopédie libre. 19 juin 2019, 16:37 UTC. 26 juin 2019, 22:18
- Fuentes F, Quispe I, García J. Standardisation de la méthode Biuret pour quantifier les protéines totales dans le sérum antibotrope polyvalent produit au Centre national des produits biologiques de l'INS. Bol - Inst Nac Salud 2012; 18 (11-12). Disponible sur: repositorio.ins.gob.pe
- Laboratoires Winer. Protéines totales. Méthode colorimétrique pour la détermination des protéines totales dans le sérum et le plasma. Disponible sur: wiener-lab.com.ar



Personne n'a encore commenté ce post.