
Concept sensible à la chaleur, formules et exercices résolus
le chaleur sensible est l'énergie thermique fournie à un objet qui lui fait augmenter sa température. C'est le contraire de la chaleur latente, dans laquelle l'énergie thermique n'augmente pas la température mais favorise plutôt un changement de phase, par exemple du solide au liquide..
Un exemple clarifie le concept. Supposons que nous ayons une casserole d'eau à une température ambiante de 20 ° C. Lorsque nous la plaçons sur le poêle, la chaleur fournie augmente lentement la température de l'eau jusqu'à atteindre 100 ° C (température d'ébullition de l'eau au niveau de la mer). La chaleur fournie est appelée chaleur sensible.

Une fois que l'eau atteint le point d'ébullition, la chaleur fournie par le brûleur n'élève plus la température de l'eau qui reste à 100 ° C. Dans ce cas, l'énergie thermique fournie est investie dans l'évaporation de l'eau. La chaleur fournie est latente car elle n'a pas augmenté la température, mais a plutôt provoqué un changement de la phase liquide à la phase gazeuse.
C'est un fait expérimental que la chaleur sensible nécessaire pour obtenir une certaine variation de température est directement proportionnelle à cette variation et à la masse de l'objet..
Index des articles
- 1 Concept et formules
- 1.1 Le coefficient adiabatique γ
- 1.2 Capacité thermique C
- 1.3 Chaleur spécifique dans les solides, les liquides et les gaz
- 2 Différence avec la chaleur latente
- 2.1 Comment calculer la chaleur latente?
- 3 exercices résolus
- 3.1 Exemple 1
- 3.2 Exemple 2
- 3.3 Exemple 3
- 4 Références
Concept et formules
On a observé qu'en dehors de la masse et de la différence de température, la chaleur sensible dépend également du matériau. Pour cette raison, la constante de proportionnalité entre la chaleur sensible et le produit de la masse et la différence de température est appelée chaleur spécifique.
La quantité de chaleur sensible fournie dépend également de la manière dont le processus est réalisé. Par exemple, il en va différemment si le processus est réalisé à volume constant qu'à pression constante.
La formule de la chaleur sensible dans un processus isobare, c'est-à-dire à pression constante, c'est le suivant:
Q = cp . m (TF - Tje)
Dans l'équation ci-dessus Q est la chaleur sensible fournie à l'objet de masse m, qui a élevé sa température initiale Tje jusqu'à la valeur finale Tf. Dans l'équation ci-dessus, il apparaît également cp, qui est la chaleur spécifique du matériau à pression constante car le processus a été réalisé de cette manière.
Notez également que la chaleur sensible est positive lorsqu'elle est absorbée par l'objet et provoque une élévation de température..
Dans le cas où la chaleur est fournie à un gaz enfermé dans un récipient rigide, le processus sera isochorique, c'est-à-dire à volume constant; et la formule de la chaleur sensible s'écrira comme ceci:
Q = cv. m. (TF - Tje)
Le coefficient adiabatique γ
Le quotient entre la chaleur spécifique à pression constante et la chaleur spécifique à volume constant pour le même matériau ou substance est appelé coefficient adiabatique, qui est généralement désigné par la lettre grecque gamma γ.
le coefficient adiabatique est supérieur à l'unité. La chaleur nécessaire pour élever la température d'un corps d'un gramme de masse d'un degré est plus élevée dans un processus isobare que dans un processus isochore..
En effet, dans le premier cas, une partie de la chaleur est utilisée pour effectuer des travaux mécaniques.
En plus de la chaleur spécifique, la capacité thermique d'un corps est également souvent définie. C'est la quantité de chaleur nécessaire pour élever la température de ce corps d'un degré centigrade.
Capacité thermique C
La capacité thermique est désignée par C majuscule, tandis que la chaleur spécifique avec c minuscules. La relation entre les deux quantités est:
C = c⋅ m
Où m est la masse du corps.
La chaleur spécifique molaire est également utilisée, qui est définie comme la quantité de chaleur sensible nécessaire pour élever la température d'une mole de substance d'un degré Celsius ou Kelvin..
Chaleur spécifique dans les solides, les liquides et les gaz
La chaleur spécifique molaire de la plupart des solides a une valeur proche de 3 fois R, où R est la constante de gaz universelle. R = 8,314472 J / (mol ℃).
Par exemple, l'aluminium a une chaleur spécifique molaire 24,2 J / (mol ℃), le cuivre 24,5 J / (mol ℃), l'or 25,4 J / (mol ℃), et le fer doux 25,1 J / (mol ℃). Notez que ces valeurs sont proches de 3R = 24,9 J / (mol ℃).
En revanche, pour la plupart des gaz, la chaleur spécifique molaire est proche de n (R / 2), où est n un entier et R est la constante de gaz universelle. Le nombre entier n est lié au nombre de degrés de liberté de la molécule qui compose le gaz.
Par exemple, dans un gaz parfait monoatomique, dont la molécule n'a que les trois degrés de liberté de translation, la chaleur spécifique molaire à volume constant est 3 (R / 2). Mais s'il s'agit d'un gaz diatomique idéal, il y a en plus deux degrés de rotation, donc cv = 5 (R / 2).
Dans les gaz parfaits, la relation suivante entre la chaleur spécifique molaire à pression constante et le volume constant est valable: cp = cv + R.
Une mention spéciale mérite l'eau. À l'état liquide à 25 ℃ l'eau a cp = 4,1813 J / (g ℃), la vapeur d'eau à 100 degrés centigrades a cp = 2 080 J / (g ℃) et l'eau glacée à zéro degré Celsius a cp = 2 050 J / (g ℃).
Différence avec la chaleur latente
La matière peut être dans trois états: solide, liquide et gazeux. L'énergie est nécessaire pour changer d'état, mais chaque substance y répond d'une manière différente en fonction de ses caractéristiques moléculaires et atomiques..
Lorsqu'un solide fond ou qu'un liquide s'évapore, la température de l'objet reste constante jusqu'à ce que toutes les particules aient changé d'état..
Pour cette raison, il est possible qu'une substance soit en équilibre en deux phases: solide - liquide ou liquide - vapeur, par exemple. Une quantité de substance peut passer d'un état à un autre en ajoutant ou en supprimant un peu de chaleur, tandis que la température reste fixe..
La chaleur fournie à un matériau fait vibrer ses particules plus rapidement et augmente leur énergie cinétique. Cela se traduit par une augmentation de la température.
Il est possible que l'énergie qu'ils acquièrent soit si grande qu'ils ne reviennent plus à leur position d'équilibre et que la séparation entre eux augmente. Lorsque cela se produit, la température n'augmente pas, mais la substance passe du solide au liquide ou du liquide au gaz.
La chaleur nécessaire pour que cela se produise est connue sous le nom de chaleur latente. Par conséquent, la chaleur latente est la chaleur par laquelle une substance peut changer de phase.
Voici la différence avec la chaleur sensible. Une substance qui absorbe la chaleur sensible augmente sa température et reste dans le même état.
Comment calculer la chaleur latente?
La chaleur latente est calculée par l'équation:
Q = m. L
Où L ce peut être la chaleur spécifique de vaporisation ou la chaleur de fusion. Les unités de L sont énergie / masse.
Les scientifiques ont donné à la chaleur de nombreux noms, selon le type de réaction à laquelle elle participe. Par exemple, il y a la chaleur de réaction, la chaleur de combustion, la chaleur de solidification, la chaleur de solution, la chaleur de sublimation et bien d'autres..
Les valeurs de bon nombre de ces types de chaleur pour différentes substances sont présentées sous forme de tableau.
Exercices résolus
Exemple 1
Supposons un qui a un morceau d'aluminium d'une masse de 3 kg. Au départ, il est à 20 ° C et vous souhaitez augmenter sa température à 100 ° C. Calculez la chaleur sensible requise.
Solution
Nous devons d'abord connaître la chaleur spécifique de l'aluminium
cp = 0,897 J / (g ° C)
Ensuite, la quantité de chaleur nécessaire pour chauffer la pièce d'aluminium sera
Q = cp m (Tf - Ti) = 0,897 * 3000 * (100 - 20) J
Q = 215 280 J
Exemple 2
Calculez la quantité de chaleur nécessaire pour chauffer 1 litre d'eau de 25 ° C à 100 ° C au niveau de la mer. Exprimer le résultat également en kilocalories.
Solution
La première chose à retenir est qu'un litre d'eau pèse 1 kg, soit 1000 grammes.
Q = cp m (Tf - Ti) = 4,1813 J / (g ℃) * 1000 g * (100 ℃ - 25 ℃) = 313597,5 J
La calorie est une unité d'énergie définie comme la chaleur sensible nécessaire pour élever un gramme d'eau d'un degré Celsius. Par conséquent, 1 calorie équivaut à 4,1813 Joules.
Q = 313597,5 J * (1 cal / 4,1813 J) = 75000 cal = 75 kcal.
Exemple 3
Un morceau de matériau de 360,16 grammes est chauffé de 37 ℃ à 140 ℃. L'énergie thermique fournie est de 1150 calories.
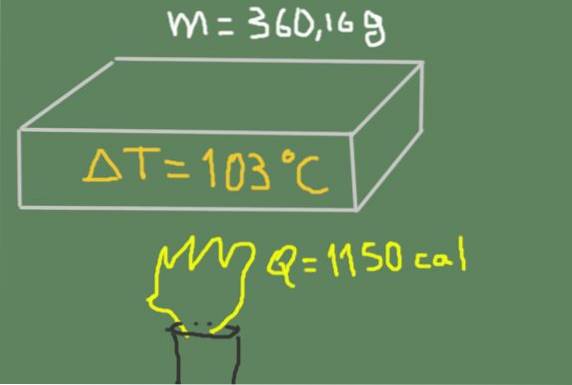
Trouvez la chaleur spécifique du matériau.
Solution
On peut écrire la chaleur spécifique en fonction de la chaleur sensible, de la masse et de la variation de la température selon la formule:
cp = Q / (m ΔT)
En remplaçant les données, nous avons les éléments suivants:
cp = 1150 cal / (360,16 g * (140 ℃ - 37 ℃)) = 0,0310 cal / (g ℃)
Mais comme une calorie est égale à 4,1813 J, le résultat peut également être exprimé comme
cp = 0,130 J / (g ℃)
Les références
- Giancoli, D. 2006. Physique: principes avec applications. 6e. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, L. 2007. Physique: un regard sur le monde. 6ta Edition abrégée. Apprentissage Cengage. 156 - 164.
- Tippens, P. 2011. Physique: concepts et applications. 7ème. Édition révisée. McGraw Hill. 350 - 368.
- Rex, A. 2011. Fondamentaux de la physique. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Physique universitaire et physique moderne. 14e. Volume 1. 556 - 553.
- Serway, R., Vulle, C. 2011. Principes de base de la physique. 9n / A Apprentissage Cengage. 362 - 374.


Personne n'a encore commenté ce post.