
Caractéristiques, types et exemples du carbone primaire
le carbone primaire C'est celui qui, dans tout composé, quel que soit son environnement moléculaire, forme une liaison avec au moins un autre atome de carbone. Cette liaison peut être simple, double (=) ou triple (≡), tant qu'il n'y a que deux atomes de carbone liés et dans des positions adjacentes (logiquement).
Les hydrogènes présents sur ce carbone sont appelés hydrogènes primaires. Cependant, les caractéristiques chimiques des hydrogènes primaires, secondaires et tertiaires diffèrent peu et sont principalement soumises aux environnements moléculaires du carbone. C'est pour cette raison que le carbone primaire (1 °) est généralement traité avec plus d'importance que ses hydrogènes.
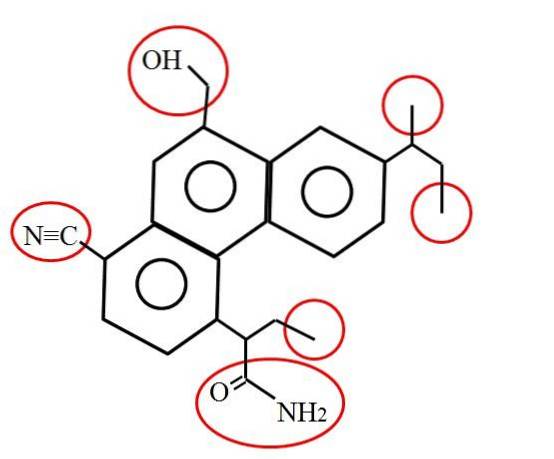
Et à quoi ressemble un carbone primaire? La réponse dépend, comme mentionné, de votre environnement moléculaire ou chimique. Par exemple, l'image ci-dessus indique les carbones primaires, entourés de cercles rouges, dans la structure d'une molécule hypothétique (bien que probablement réelle)..
Si vous regardez attentivement, vous constaterez que trois d'entre eux sont identiques; tandis que les trois autres sont totalement différents. Les trois premiers sont constitués de groupes méthyle, -CH3 (à droite de la molécule), et les autres sont les groupes méthylol, -CHdeuxOH, nitrile, -CN et un amide, RCONHdeux (à gauche de la molécule et en dessous).
Index des articles
- 1 Caractéristiques du carbone primaire
- 1.1 Localisation et liens
- 1.2 Faible obstacle stérique
- 1.3 Réactivité
- 2 types
- 3 exemples
- 3.1 Aldéhydes et acides carboxyliques
- 3.2 Dans les amines linéaires
- 3.3 Dans les halogénures d'alkyle
- 4 Références
Caractéristiques du carbone primaire
Localisation et liens
Six carbones primaires ont été montrés ci-dessus, sans aucun commentaire autre que leurs emplacements et quels autres atomes ou groupes les accompagnent. Ils peuvent être n'importe où dans la structure, et où qu'ils soient, ils marquent la «fin de la route»; c'est-à-dire là où se termine une section du squelette. C'est pourquoi ils sont parfois appelés carbones terminaux..
Ainsi, il est évident que les groupes -CH3 ils sont terminaux et leur carbone est de 1 °. Notez que ce carbone se lie à trois hydrogènes (qui ont été omis dans l'image) et à un seul carbone, complétant leurs quatre liaisons respectives..
Par conséquent, ils sont tous caractérisés par une liaison C-C, une liaison qui peut également être double (C = CHdeux) ou triple (C≡CH). Cela reste vrai même s'il y a d'autres atomes ou groupes attachés à ces carbones; comme pour les trois autres carbones 1 ° restants de l'image.
Faible obstacle stérique
Il a été mentionné que les carbones primaires sont terminaux. En signalant la fin d'un tronçon du squelette, aucun autre atome n'interfère spatialement avec eux. Par exemple, les groupes -CH3 ils peuvent interagir avec des atomes d'autres molécules; mais leurs interactions avec les atomes voisins de la même molécule sont faibles. Il en va de même pour le -CHdeuxOH et -CN.
En effet, ils sont pratiquement exposés au «vide». Par conséquent, ils présentent généralement un faible encombrement stérique par rapport aux autres types de carbone (2e, 3e et 4e).
Cependant, il existe des exceptions, le produit d'une structure moléculaire avec trop de substituants, une flexibilité élevée ou une tendance à se refermer sur elle-même..
Réactivité
Une des conséquences de l'encombrement stérique inférieur autour du 1er carbone est une plus grande exposition à réagir avec d'autres molécules. Moins d'atomes obstruent le chemin de la molécule attaquante vers elle, plus sa réaction sera probable..
Mais cela n'est vrai que du point de vue stérique. En fait, le facteur le plus important est le facteur électronique; c'est-à-dire quel est l'environnement desdits carbones 1 °.
Le carbone adjacent au primaire lui transfère une partie de sa densité électronique; et la même chose peut se produire dans la direction opposée, favorisant un certain type de réaction chimique.
Ainsi, les facteurs stériques et électroniques expliquent pourquoi il est généralement le plus réactif; bien qu'il n'y ait pas vraiment de règle de réactivité globale pour tous les carbones primaires.
Les types
Les carbones primaires n'ont pas de classification intrinsèque. Au lieu de cela, ils sont classés sur la base des groupes d'atomes auxquels ils appartiennent ou auxquels ils sont liés; Ce sont les groupes fonctionnels. Et comme chaque groupe fonctionnel définit un type spécifique de composé organique, il existe différents carbones primaires.
Par exemple, le groupe -CHdeuxOH est dérivé de l'alcool primaire RCHdeuxOH. Les alcools primaires sont donc constitués de 1 ° carbones liés au groupe hydroxyle, -OH.
Le groupe nitrile, -CN ou -C≡N, par contre, ne peut être attaché directement à un atome de carbone que par la simple liaison C-CN. Ainsi, l'existence de nitriles secondaires (RdeuxCN) ou beaucoup moins tertiaire (R3CN).
Un cas similaire se produit avec le substituant dérivé de l'amide, -CONHdeux. Il peut subir des substitutions des hydrogènes de l'atome d'azote; mais son carbone ne peut se lier qu'à un autre carbone, et donc il sera toujours considéré comme primaire, C-CONHdeux.
Et par rapport au groupe -CH3, C'est un substitut alkyle qui ne peut se lier qu'à un autre carbone, étant donc primaire. Si le groupe éthyle est considéré, -CHdeuxCH3, on remarquera immédiatement que le CHdeux, groupe méthylène, est un carbone 2 ° car il est lié à deux carbones (C-CHdeuxCH3).
Exemples
Aldéhydes et acides carboxyliques
On a mentionné quelques exemples de carbones primaires. En plus d'eux, il existe la paire de groupes suivante: -CHO et -COOH, appelés respectivement formyle et carboxyle. Les carbones de ces deux groupes sont primaires, car ils formeront toujours des composés de formules RCHO (aldéhydes) et RCOOH (acides carboxyliques).
Cette paire est étroitement liée l'une à l'autre en raison des réactions d'oxydation que le groupe formyle subit pour se transformer en carboxyle:
RCHO => RCOOH
Réaction subie par les aldéhydes ou le groupe -CHO s'il s'agit d'un substituant dans une molécule.
Dans les amines linéaires
La classification des amines dépend exclusivement du degré de substitution des hydrogènes du groupe -NHdeux. Cependant, dans les amines linéaires, des carbones primaires peuvent être observés, comme dans la propanamine:
CH3-CHdeux-CHdeux-NHdeux
Notez que le CH3 ce sera toujours un 1er carbone, mais cette fois le CHdeux à droite est également 1 ° car il est lié à un seul carbone et au groupe NHdeux.
Dans les halogénures d'alkyle
Un exemple très similaire au précédent est donné avec les halogénures d'alkyle (et dans de nombreux autres composés organiques). Supposons que le bromopropane:
CH3-CHdeux-CHdeux-Br
Dans celui-ci, les carbones primaires restent les mêmes.
En guise de conclusion, les 1 ° carbones transcendent le type de composé organique (et même organométallique), car ils peuvent être présents dans n'importe lequel d'entre eux et s'identifient simplement parce qu'ils sont liés à un seul carbone.
Les références
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (dixe édition.). Wiley plus.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Morrison, R. T. et Boyd, R. N. (1987). Chimie organique. (5ta Édition). Éditorial Addison-Wesley Interamericana.
- Ashenhurst J. (16 juin 2010). Primaire, Secondaire, Tertiaire, Quaternaire en Chimie Organique. Master chimie organique. Récupéré de: masterorganicchemistry.com
- Wikipédia. (2019). Carbone primaire. Récupéré de: en.wikipedia.org



Personne n'a encore commenté ce post.