
Structure, propriétés, production, utilisations du carbure de calcium (CaC2)

le carbure de calcium C'est un composé inorganique formé des éléments calcium (Ca) et carbone (C). Sa formule chimique est CaCdeux. C'est un solide qui peut être incolore à blanc jaunâtre ou grisâtre, voire noir selon les impuretés qu'il contient.
L'une de ses réactions chimiques les plus importantes du CaCdeux est ce qui se passe avec l'eau HdeuxOu, dans lequel se forme l'acétylène HC≡CH. Pour cette raison, il est utilisé pour obtenir de l'acétylène de manière industrielle. En raison de la même réaction avec l'eau, il est utilisé pour faire mûrir les fruits, dans de faux fusils et dans des fusées éclairantes navales..

La réaction CaCdeux avec de l'eau produit également une boue utile pour préparer le clinker (un composant du ciment), qui produit moins de dioxyde de carbone (COdeux) par rapport à la méthode traditionnelle de production de ciment.
Avec de l'azote (Ndeux) le carbure de calcium forme du cyanamide de calcium, qui est utilisé comme engrais. Le CaCdeux il est également utilisé pour éliminer le soufre de certains alliages métalliques.
Il y a quelque temps, le CaCdeux Il était utilisé dans les lampes dites au carbure, mais celles-ci ne sont plus très courantes car elles sont dangereuses.
Index des articles
- 1 Structure
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Point de fusion
- 3.4 Point d'ébullition
- 3.5 Densité
- 3.6 Propriétés chimiques
- 4 Obtention
- 5 utilisations
- 5.1 Dans la production d'acétylène
- 5.2 En réduisant les émissions de CO2
- 5.3 Pour obtenir du cyanamide calcique
- 5.4 Dans l'industrie métallurgique
- 5.5 Dans diverses utilisations
- 5.6 Utilisation interrompue
- 6 risques
- 7 Références
Structure
Le carbure de calcium est un composé ionique et est composé de l'ion calcium Cadeux+ et l'ion carbure ou acétylure Cdeuxdeux-. L'ion carbure est composé de deux atomes de carbone reliés par une triple liaison.
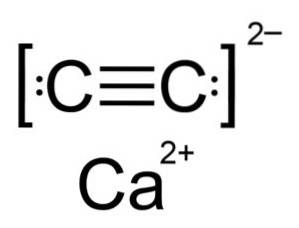
La structure cristalline du CaCdeux est dérivé du cube (comme le chlorure de sodium NaCl), mais comme l'ion Cdeuxdeux- est allongée la structure est déformée et devient tétragonale.
Nomenclature
- Carbure de calcium
- Carbure de calcium
- Acétylure de calcium
Propriétés
État physique
Solide cristallin qui, lorsqu'il est pur est incolore, mais s'il est contaminé par d'autres composés, il peut être blanc jaunâtre ou grisâtre à noir.

Poids moléculaire
64,0992 g / mol
Point de fusion
2160 ºC
Point d'ébullition
Le CaCdeux il bout à 2300 ºC avec décomposition. Le point d'ébullition doit être mesuré sous atmosphère inerte, c'est-à-dire sans oxygène ni humidité..
Densité
2,22 g / cm3
Propriétés chimiques
Le carbure de calcium réagit avec l'eau pour former de l'acétylène HC≡CH et de l'hydroxyde de calcium Ca (OH)deux:
CaCdeux + 2 heuresdeuxO → HC≡CH + Ca (OH)deux
L'acétylène est inflammable, donc CaC en présence d'humiditédeux il peut être inflammable. Cependant, lorsqu'il est sec, il n'est pas.

Le carbure de calcium réagit avec l'azote Ndeux pour former du cyanamide calcique CaCNdeux:
CaCdeux + Ndeux → CaCNdeux + C
Obtention
Le carbure de calcium est produit industriellement dans un four à arc électrique à partir d'un mélange de carbonate de calcium (CaCO3) et du carbone (C) soumis à une température de 2000 ° C La réaction est résumée comme ceci:
Voleur3 + 3 C → CaCdeux + CO ↑ + COdeux↑
Ou aussi:
CaO + 3 C → CaCdeux + CO ↑
Dans un four à arc électrique, un arc électrique est produit entre deux électrodes en graphite, qui résistent aux températures élevées qui se forment. Un carbure de calcium avec une pureté de 80 à 85% est obtenu.
Applications
Dans la production d'acétylène
Industriellement, la réaction du carbure de calcium avec de l'eau est utilisée pour produire de l'acétylène CdeuxHdeux.
CaCdeux + 2 heuresdeuxO → HC≡CH + Ca (OH)deux
C'est l'utilisation la plus importante du carbure de calcium. Dans certains pays, l'acétylène est très apprécié, car il permet de produire du polychlorure de vinyle, qui est un type de plastique. De plus, l'acétylène est utilisé pour souder à haute température.

En réduisant les émissions de COdeux
Les restes issus de l'obtention d'acétylène à partir de CaCdeux (également appelées «boues de carbure de calcium» ou «résidus de carbure de calcium») sont utilisées pour obtenir du clinker ou du béton.
La boue de carbure de calcium a une teneur élevée en hydroxyde de calcium (Ca (OH)deux) (environ 90%), du carbonate de calcium (CaCO3) et a un pH supérieur à 12.

Pour ces raisons, il peut réagir avec SiOdeux ou AldeuxOU ALORS3 former un produit similaire à celui obtenu par le procédé d'hydratation du ciment.
L'une des activités humaines qui produit le plus d'émissions de COdeux c'est l'industrie de la construction. Le COdeux est généré à l'est se détache du carbonate de calcium lors de la réaction pour former du béton.
Utilisation de boues de carbure de calcium pour remplacer le carbonate de calcium (CaCO3) réduit les émissions de COdeux de 39%.
Pour obtenir du cyanamide calcique
Le carbure de calcium est également utilisé industriellement pour obtenir du cyanamide calcique CaCNdeux.
CaCdeux + Ndeux → CaCNdeux + C
Le cyanamide de calcium est utilisé comme engrais, car avec l'eau du sol, il est converti en cyanamide H2N = C = N, qui fournit de l'azote aux plantes, un nutriment essentiel pour elles.
Dans l'industrie métallurgique
Le carbure de calcium est utilisé pour éliminer le soufre des alliages tels que le ferronickel. CaC est mélangédeux avec l'alliage fondu à 1550 ° C Le soufre (S) réagit avec le carbure de calcium et produit du sulfure de calcium CaS et du carbone C:
CaCdeux + S → 2 C + CaS
L'élimination du soufre est favorisée si le mélange est efficace et si la teneur en carbone de l'alliage est faible. Le sulfure de calcium CaS flotte à la surface de l'alliage fondu d'où il est décanté et jeté..
Dans diverses utilisations
Le carbure de calcium a été utilisé pour éliminer le soufre du fer. Aussi comme carburant dans la production d'acier et comme puissant désoxydant.
Il est utilisé pour faire mûrir les fruits. L'acétylène est généré à partir de carbure de calcium avec de l'eau, ce qui induit la maturation des fruits, comme les bananes..

Le carbure de calcium est utilisé dans les pistolets factices pour provoquer le bruit de détonation qui les caractérise. Ici aussi, la formation d'acétylène est utilisée, qui explose avec une étincelle à l'intérieur de l'appareil.
Le CaCdeux utilisé pour générer des signaux au large des fusées éclairantes navales.
Utilisation interrompue
Le CaCdeux il a été utilisé dans des lampes dites au carbure. Le fonctionnement de ceux-ci consiste à faire couler de l'eau sur le carbure de calcium pour former de l'acétylène, qui s'enflamme et fournit ainsi de la lumière..
Ces lampes ont été utilisées dans les mines de charbon, mais leur utilisation a été interrompue en raison de la présence du gaz méthane CH4 dans ces mines. Ce gaz est inflammable et la flamme de la lampe au carbure peut provoquer son inflammation ou son explosion..

Ils étaient largement utilisés dans les mines d'ardoise, de cuivre et d'étain, ainsi que dans les premières automobiles, motos et vélos, comme phares ou phares..
Actuellement, ils ont été remplacés par des lampes électriques ou même des lampes LED. Cependant, ils sont toujours utilisés dans des pays comme la Bolivie, dans les mines d'argent de Potosí.
Des risques
Carbure de calcium CaCdeux à sec, il n'est pas inflammable mais en présence d'humidité, il forme rapidement de l'acétylène, ce qu'il est.
Pour éteindre un incendie en présence de CaCdeux les extincteurs à eau, à mousse, au dioxyde de carbone ou à halogène ne doivent jamais être utilisés. Il faut utiliser du sable ou de l'hydroxyde de sodium ou de calcium.
Les références
- Ropp, R.C. (2013). Composés alcalino-terreux du groupe 14 (C, Si, Ge, Sn et Pb). Carbures de calcium. Dans l'Encyclopédie des composés alcalino-terreux. Récupéré de sciencedirect.com.
- Pohanish, R. P. (2017). C. Carbure de calcium. In Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens (septième édition). Récupéré de sciencedirect.com.
- Sun, H. et coll. (2015). Propriétés du résidu de carbure de calcium brûlé chimiquement et son influence sur les propriétés du ciment. Matériaux 2015, 8, 638-651. Récupéré de ncbi.nlm.nih.gov.
- Nie, Z. (2016). Évaluation des éco-matériaux et du cycle de vie. Étude de cas: COdeux Analyse des émissions de clinker de boue de carbure de calcium. Dans la fabrication verte et durable de matériaux avancés. Récupéré de sciencedirect.com.
- Crundwell, F.K. Et al. (2011). Raffinage du ferronickel fondu. Élimination du soufre. Dans la métallurgie extractive des métaux du groupe du nickel, du cobalt et du platine. Récupéré de sciencedirect.com.
- Tressler, R.E. (2001). Céramiques structurelles et thermostructurales. Carbures. Dans Encyclopédie de la science et de la technologie des matériaux. Récupéré de sciencedirect.com.
- Cotton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley et fils.


Personne n'a encore commenté ce post.