
Propriétés des esters, structure, utilisations, exemples
Les les esters Ce sont des composés organiques qui ont un composant acide carboxylique et un composant alcool. Sa formule chimique générale est RCOdeuxR' ou RCOOR'. Le côté droit, RCOO, correspond au groupe carboxyle, tandis que le côté droit, OU' c'est de l'alcool. Les deux partagent un atome d'oxygène et partagent une certaine ressemblance avec les éthers (ROR ').
Pour cette raison, l'acétate d'éthyle, CH3COOCHdeuxCH3, le plus simple des esters, il était considéré comme le acide acétique ou éther de vinaigre, et d'où l'origine étymologique du nom «ester». Donc un ester consiste en la substitution de l'hydrogène acide du groupe COOH, par un groupe alkyle d'un alcool.

Où trouve-t-on les esters? Des sols à la chimie organique, ses sources naturelles sont nombreuses. L'odeur agréable des fruits, tels que les bananes, les poires et les pommes, est le produit de l'interaction d'esters avec de nombreux autres composants. On les trouve également sous forme de triglycérides dans les huiles ou les graisses.
Notre corps fabrique des triglycérides à partir d'acides gras, qui ont de longues chaînes carbonées, et d'alcool glycérol. Ce qui différencie certains esters des autres réside à la fois dans R, la chaîne du composant acide, et R ', celle du composant alcoolique..
Un ester de bas poids moléculaire doit avoir peu de carbones dans R et R ', tandis que d'autres, comme les cires, ont de nombreux carbones en particulier dans R', le composant alcoolique, et donc des poids moléculaires élevés..
Cependant, tous les esters ne sont pas strictement organiques. Si l'atome de carbone du groupe carbonyle est remplacé par un atome de phosphore, alors nous aurons RPOOR '. Ceci est connu comme un ester de phosphate, et ils sont d'une importance cruciale dans la structure de l'ADN..
Ainsi, tant qu'un atome peut se lier efficacement au carbone ou à l'oxygène, comme le soufre (RSOOR '), il peut par conséquent former un ester inorganique.
Index des articles
- 1 Propriétés
- 1.1 Solubilité dans l'eau
- 1.2 Réaction d'hydrolyse
- 1.3 Réaction de réduction
- 1.4 Réaction de transestérification
- 2 Structure
- 2.1 Accepteur de liaison hydrogène
- 3 Nomenclature
- 4 Comment se forment-ils?
- 4.1 Estérification
- 4.2 Esters de chlorures d'acyle
- 5 utilisations
- 6 exemples
- 7 Références
Propriétés
Les esters ne sont ni des acides ni des alcools, ils ne se comportent donc pas comme tels. Leurs points de fusion et d'ébullition, par exemple, sont inférieurs à ceux ayant des poids moléculaires similaires, mais plus proches en valeurs de ceux des aldéhydes et des cétones..
Acide butanoïque, CH3CHdeuxCHdeuxCOOH, a un point d'ébullition de 164 ° C, tandis que l'acétate d'éthyle, CH3COOCHdeuxCH3, de 77,1 ° C.
Hormis l'exemple récent, les points d'ébullition du 2-méthylbutane, CH3CH (CH3) CHdeuxCH3, d'acétate de méthyle, CH3COOCH3, et 2-butanol, CH3,CH (OH) CHdeuxCH3, ils sont les suivants: 28, 57 et 99 ° C. Les trois composés ont des poids moléculaires de 72 et 74 g / mol..
Les esters de bas poids moléculaire ont tendance à être volatils et à avoir des odeurs agréables, c'est pourquoi leur contenu en fruits leur confère leurs parfums familiers. Par contre, lorsque leurs poids moléculaires sont élevés, ils sont des solides cristallins incolores et inodores ou, selon leur structure, présentent des caractéristiques grasses..
Solubilité dans l'eau
Les acides carboxyliques et les alcools sont généralement solubles dans l'eau, à moins qu'ils n'aient un caractère hydrophobe élevé dans leurs structures moléculaires. Il en va de même pour les esters. Lorsque R ou R 'sont des chaînes courtes, l'ester peut interagir avec les molécules d'eau par les forces dipôle-dipôle et les forces de London..
En effet, les esters sont des accepteurs de liaisons hydrogène. Comment? Par ses deux atomes d'oxygène RCOOR '. Les molécules d'eau forment des liaisons hydrogène avec l'un de ces oxygènes. Mais lorsque les chaînes R ou R 'sont très longues, elles repoussent l'eau dans leur environnement, rendant impossible leur dissolution..
Un exemple évident de ceci se produit avec les esters de triglycérides. Ses chaînes latérales sont longues et rendent les huiles et graisses insolubles dans l'eau, à moins qu'elles ne soient en contact avec un solvant moins polaire, plus proche de ces chaînes..
Réaction d'hydrolyse
Les esters peuvent également réagir avec les molécules d'eau dans ce que l'on appelle une réaction d'hydrolyse. Cependant, ils nécessitent un milieu suffisamment acide ou basique pour favoriser le mécanisme de ladite réaction:
RCOOR ' + HdeuxOU ALORS <=> RCOOh + R'OH
(Milieu acide)
La molécule d'eau s'ajoute au groupe carbonyle, C = O. L'hydrolyse acide se résume à la substitution de chaque R 'du composant alcoolique par un OH de l'eau. Notez également comment l'ester «se brise» en ses deux composants: l'acide carboxylique, RCOOH, et l'alcool R'OH..
RCOOR ' + Oh- => RCOOU ALORS- + R'OH
(Moyen de base)
Lorsque l'hydrolyse est effectuée dans un milieu basique, une réaction irréversible se produit connue sous le nom de saponification. Ceci est largement utilisé et constitue la pierre angulaire de la production de savons artisanaux ou industriels..
Le RCOO- est l'anion carboxylate stable, qui s'associe électrostatiquement au cation prédominant dans le milieu.
Si la base utilisée est NaOH, le sel RCOONa se forme. Lorsque l'ester est un triglycéride, qui, par définition, a trois chaînes latérales R, il se forme trois sels d'acides gras, RCOONa, et l'alcool glycérol.
Réaction de réduction
Les esters sont des composés hautement oxydés. Que voulez-vous dire? Cela signifie qu'il a plusieurs liaisons covalentes avec l'oxygène. En éliminant les liaisons C-O, une rupture se produit qui finit par séparer les composants acides et alcooliques; De plus, l'acide est réduit à une forme moins oxydée, en un alcool:
RCOOR '=> RCHdeuxOH + R'OH
C'est la réaction de réduction. Un agent réducteur fort est nécessaire, tel que l'hydrure de lithium et d'aluminium, LiAlH4, et à partir d'un milieu acide qui favorise la migration des électrons. Les alcools sont les formes les plus petites, c'est-à-dire celles avec les liaisons les moins covalentes avec l'oxygène (une seule: C-OH).
Les deux alcools, RCHdeuxOH + R'OH, proviennent des deux chaînes respectives de l'ester RCOOR 'original. Il s'agit d'une méthode de synthèse d'alcools à valeur ajoutée à partir de leurs esters. Par exemple, si vous vouliez fabriquer un alcool à partir d'une source exotique d'esters, ce serait une bonne voie à cette fin..
Réaction de transestérification
Les esters peuvent être transformés en d'autres s'ils réagissent dans des environnements acides ou basiques avec des alcools:
RCOOR ' + R "OH <=> RCOOU ALORS " + R'OH
Structure
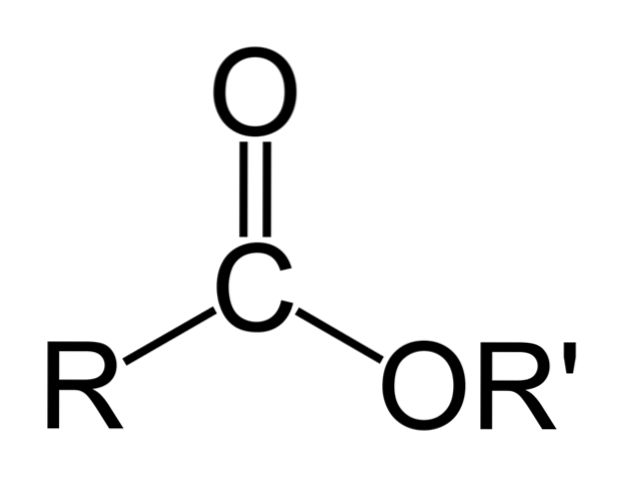
L'image du haut représente la structure générale de tous les esters organiques. Notez que R, le groupe carbonyle C = O, et OR ', forment un triangle plat, produit de l'hybridation spdeux de l'atome de carbone central. Cependant, les autres atomes peuvent adopter d'autres géométries, et leurs structures dépendent de la nature intrinsèque de R ou R '.
Si R ou R 'sont de simples chaînes alkyle, par exemple du type (CHdeux)nCH3, ceux-ci apparaîtront en zigzag dans l'espace. C'est le cas du butanoate de pentyle, CH3CHdeuxCHdeuxCOOCHdeuxCHdeuxCHdeuxCHdeuxCH3.
Mais dans n'importe lequel des carbones de ces chaînes, une ramification ou une insaturation pourrait être trouvée (C = C, C≡C), ce qui modifierait la structure globale de l'ester. Et pour cette raison, ses propriétés physiques, telles que la solubilité et ses points d'ébullition et de fusion, varient avec chaque composé..
Par exemple, les graisses insaturées ont des doubles liaisons dans leurs chaînes R, qui influencent négativement les interactions intermoléculaires. En conséquence, leurs points de fusion chutent, jusqu'à ce qu'ils soient liquides, ou huileux, à température ambiante..
Accepteur de liaison hydrogène
Bien que le triangle du squelette ester se détache davantage sur l'image, ce sont les chaînes R et R 'qui sont responsables de la diversité de leurs structures.
Cependant, le triangle mérite une caractéristique structurelle des esters: ce sont des accepteurs de liaisons hydrogène. Comment? Par l'oxygène des groupes carbonyle et alcoolate (le -OR ').
Ceux-ci ont des paires d'électrons libres, qui peuvent attirer des atomes d'hydrogène chargés partiellement positifs à partir des molécules d'eau..
Par conséquent, il s'agit d'un type particulier d'interactions dipôle-dipôle. Les molécules d'eau s'approchent de l'ester (si elles ne sont pas empêchées par les chaînes R ou R ') et les ponts C = O-H se formentdeuxO ou OHdeux-OU ALORS '.
Nomenclature
Comment les esters sont-ils nommés? Pour nommer correctement un ester, il est nécessaire de prendre en compte les nombres de carbone des chaînes R et R '. De même, toute ramification, substituant ou insaturations possibles.
Une fois cela fait, au nom de chaque R 'du groupe alcoxyde -OR' est ajouté le suffixe -yle, tandis qu'à la chaîne R du groupe carboxyle -COOR, le suffixe -ate. La section R est mentionnée en premier, suivie du mot «de» puis du nom de la section R ».
Par exemple, le CH3CHdeuxCHdeuxCOOCHdeuxCHdeuxCHdeuxCHdeuxCH3 Il a cinq carbones sur le côté droit, c'est-à-dire qu'ils correspondent à R '. Et sur le côté gauche, il y a quatre atomes de carbone (y compris le groupe carbonyle C = O). Par conséquent, R 'est un groupe pentyle et R un butane (pour inclure le carbonyle et considérer la chaîne principale).
Donc, pour nommer le composé, ajoutez simplement les suffixes correspondants et nommez-les dans le bon ordre: butanelié par pentilo.
Comment nommer le composé suivant: CH3CHdeuxCOOC (CH3)3? La chaîne -C (CH3)3 correspond au substituant tert-butylalkyle. Puisque le côté gauche a trois carbones, c'est un «propane». Son nom est alors: propanelié par tert-butilo.
Comment sont-ils formés?
Estérification
Il existe de nombreuses voies pour synthétiser l'ester, dont certaines peuvent même être nouvelles. Cependant, ils convergent tous sur le fait que le triangle à l'image de la structure doit être formé, c'est-à-dire la liaison CO-O. Pour cela, vous devez partir d'un composé qui a précédemment le groupe carbonyle: comme un acide carboxylique.
Et à quoi l'acide carboxylique doit-il se lier? À un alcool, sinon il n'aurait pas le composant alcoolique qui caractérise les esters. Cependant, les acides carboxyliques nécessitent de la chaleur et de l'acidité pour permettre au mécanisme de réaction de se dérouler. L'équation chimique suivante représente ce qui précède:
RCOOH + R'OH <=> RCOOR '+ HdeuxOU ALORS
(Milieu acide)
Ceci est connu comme le estérification.
Par exemple, les acides gras peuvent être estérifiés avec du méthanol, CH3OH, pour remplacer son H acide par des groupes méthyle, de sorte que cette réaction peut également être considérée comme méthylation. Il s'agit d'une étape importante lors de la détermination du profil en acides gras de certaines huiles ou graisses..
Esters de chlorures d'acyle
Une autre façon de synthétiser les esters est à partir de chlorures d'acyle, RCOCl. Dans eux, au lieu de substituer un groupe hydroxyle OH, l'atome Cl est substitué:
RCOCl + R'OH => RCOOR '+ HCl
Et contrairement à l'estérification d'un acide carboxylique, il n'y a pas de libération d'eau mais d'acide chlorhydrique.
D'autres méthodes sont disponibles dans le monde de la chimie organique, comme l'oxydation de Baeyer-Villiger, qui utilise des peroxyacides (RCOOOH)..
Applications

Parmi les principales utilisations des esters figurent:
-En faisant des bougies ou des cierges, comme celui de l'image ci-dessus. Des esters à très longues chaînes latérales sont utilisés à cet effet..
-En tant que conservateurs de médicaments ou d'aliments. Cela est dû à l'action des parabens, qui ne sont rien de plus que des esters de l'acide para-hydroxybenzoïque. Bien qu'ils préservent la qualité du produit, il existe des études qui remettent en question son effet positif sur le corps.
-Ils sont utilisés pour la fabrication de parfums artificiels qui imitent l'odeur et le goût de nombreux fruits ou fleurs. Ainsi, les esters sont présents dans les bonbons, les glaces, les parfums, les cosmétiques, les savons, les shampooings, entre autres produits commerciaux qui méritent des arômes ou des saveurs attractifs..
-Les esters peuvent également avoir un effet pharmacologique positif. Pour cette raison, l'industrie pharmaceutique s'est consacrée à la synthèse d'esters dérivés d'acides présents dans l'organisme pour évaluer toute amélioration possible dans le traitement des maladies. L'aspirine est l'un des exemples les plus simples de ces esters.
-Les esters liquides, tels que l'acétate d'éthyle, sont des solvants appropriés pour certains types de polymères, tels que la nitrocellulose et une large gamme de résines.
Exemples
Voici quelques exemples supplémentaires d'esters:
-Butanoate de pentyle, CH3CHdeuxCHdeuxCOOCHdeuxCHdeuxCHdeuxCHdeuxCH3, qui sent l'abricot et la poire.
-Acétate de vinyle, CH3COOCHdeux= CHdeux, à partir duquel le polymère d'acétate de polyvinyle est produit.
-Pentanoate d'isopentyle, CH3CHdeuxCHdeuxCHdeuxCOOCHdeuxCHdeuxCH (CH3)deux, qui imite le goût des pommes.
-Propanoate d'éthyle, CH3CHdeuxCOOCHdeuxCH3.
-Méthanoate de propyle, HCOOCHdeuxCHdeuxCH3.
Les références
- T.W. Graham Solomons, Craigh B. Fryhle. Chimie organique. (Dixième édition, p 797-802, 820) Wiley Plus.
- Carey, F. A. Chimie organique (2006) Sixième édition. Maison d'édition Mc Graw Hill-
- Chimie LibreTexts. Nomenclature des esters. Récupéré de: chem.libretexts.org
- Admin. (2015, 19 septembre). Esters: sa nature chimique, ses propriétés et ses utilisations. Tiré de: pure-chemical.com
- La chimie organique dans notre vie quotidienne. (9 mars 2014). Quelles sont les utilisations des esters? Récupéré de: gen2chemistassignment.weebly.com
- Quimicas.net (2018). Exemples d'esters. Récupéré de: quimicas.net
- Paz María de Lourdes Cornejo Arteaga. Principales applications des esters. Tiré de: uaeh.edu.mx
- Jim Clark. (Janvier 2016). Présentation des esters. Tiré de: chemguide.co.uk



Personne n'a encore commenté ce post.