
Formation de cations, différences avec l'anion et exemples

UNE cation c'est une espèce chimique qui a une charge positive. Avec l'anion, il forme les deux types d'ions existants. Sa charge est le produit d'une carence en électrons dans l'atome, ce qui fait que les protons du noyau exercent une plus grande attraction. Pour chaque électron perdu par un atome neutre, la charge positive augmente d'une unité..
Si un atome perd un électron, et donc que le nombre de protons est supérieur à un, alors sa charge positive sera +1; si vous perdez deux électrons, la charge sera de +2, et ainsi de suite. Lorsqu'un cation a une charge +1, on dit qu'il est monovalent; par contre, si ladite charge est supérieure à +1, le cation est dit polyvalent.
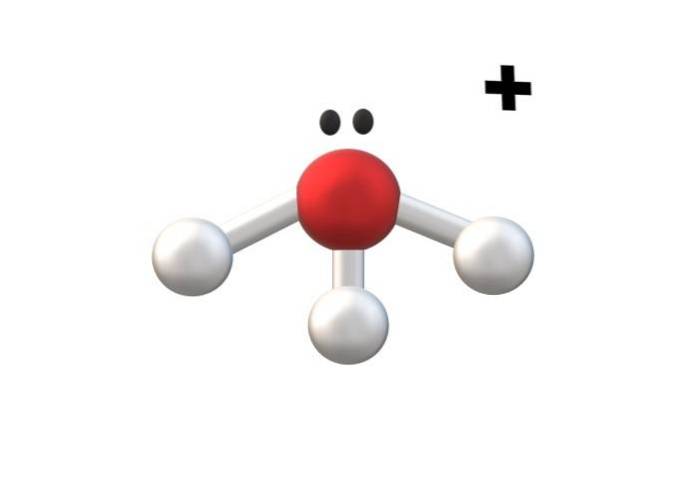
L'image ci-dessus montre le cation H3OU ALORS+, appelé ion hydronium. Comme on peut le voir, il a à peine une charge de +1, étant par conséquent un cation monovalent.
Les cations sont des espèces importantes, car ils exercent une force électrostatique sur leur environnement et les molécules qui les entourent. Ils présentent une forte interaction avec l'eau, un liquide qui les hydrate et les transporte dans les sols humides, pour atteindre plus tard les racines des plantes et être utilisés pour leurs fonctions physiologiques..
Index des articles
- 1 Comment se forme un cation?
- 1.1 Frais formels et autres liens
- 1.2 Oxydation
- 2 Différences avec l'anion
- 3 Exemples des cations les plus courants
- 3.1 Monatomique
- 3.2 Polyatomique
- 4 Références
Comment se forme un cation?
Il a été mentionné que lorsqu'un atome perd un électron, son plus grand nombre de protons, par rapport aux électrons, exerce une force d'attraction qui se traduit par une charge positive. Mais comment la perte de l'électron peut-elle se produire? La réponse dépend de la transformation qui se produit dans les réactions chimiques.
Il est à noter que la présence d'un atome chargé positivement n'implique pas nécessairement la formation d'un cation. Pour qu'il soit considéré comme tel, il ne doit pas y avoir un atome avec une charge formelle négative qui le neutralise. Sinon, il y aurait attraction et répulsion dans le même composé et ce serait neutre.
Téléchargements formels et autres liens
Les atomes électronégatifs attirent les électrons de leurs liaisons covalentes vers eux. Même si les électrons sont partagés également, il arrivera un point où ils auront partiellement moins d'électrons que dans leur configuration basale; c'est celui de ses atomes libres sans être lié à d'autres éléments.
Ensuite, ces atomes électronégatifs commenceront à éprouver une carence en électrons, et avec elle, les protons de leurs noyaux exerceront une plus grande force d'attraction; la charge formelle positive est née. S'il n'y a qu'une seule charge formelle positive, le composé manifestera une charge ionique positive globale; ainsi le cation est né.
L'atome d'oxygène du cation H3OU ALORS+ C'est un exemple fidèle de ce qui précède. En ayant trois liaisons O-H, une de plus que dans la molécule d'eau (H-O-H), elle subit la perte d'un électron de son état basal. Les calculs officiels des frais vous permettent de déterminer quand cela se produit.
Si la formation d'une autre liaison O-H est supposée pendant un moment, le cation bivalent H sera obtenu4OU ALORSdeux+. Notez que la charge divalente au-dessus du cation s'écrit comme suit: nombre suivi du symbole «+»; de la même manière que nous procédons avec les anions.
Oxydation
Les métaux sont des formateurs de cations par excellence. Cependant, tous ne peuvent pas former de liaisons covalentes (ou du moins purement covalentes). Au lieu de cela, ils perdent des électrons pour établir des liaisons ioniques: une charge positive en attire une négative, maintenue ensemble par des forces physiques..
Par conséquent, les métaux perdent des électrons pour passer de M à Mn+, où n il est généralement égal au numéro de son groupe sur le tableau périodique; même si n il peut prendre plusieurs valeurs entières, ce qui est notamment le cas des métaux de transition. Cette perte d'électrons a lieu dans un type de réaction chimique appelée oxydation..
Les métaux s'oxydent, perdent un électron, le nombre de protons dans leurs atomes dépasse celui des électrons, et par conséquent présentent une charge positive. Pour que l'oxydation se produise, il doit y avoir un agent oxydant, qui réduit ou gagne les électrons perdus par les métaux. L'oxygène est l'agent oxydant le plus connu de tous.
Différences avec l'anion
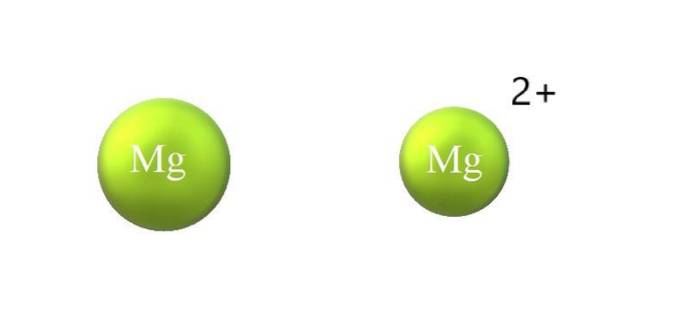
Voici les différences entre un cation et un anion:
-Le cation en général est plus petit que l'anion. L'image ci-dessus montre comment le rayon atomique de Mg est réduit en perdant deux électrons et en devenant le cation Mg.deux+; l'inverse se produit avec les anions: ils deviennent plus volumineux.
-Il a plus de protons que d'électrons, tandis que l'anion a plus d'électrons que de protons..
-Étant plus petit, sa densité de charge est plus élevée, et donc il a un plus grand pouvoir polarisant; c'est-à-dire qu'il déforme les nuages d'électrons des atomes voisins.
-Un cation se déplace dans la même direction que le champ électrique appliqué, tandis que l'anion se déplace dans la direction opposée.
Exemples des cations les plus courants
Monatomique
Les cations monatomiques proviennent principalement de métaux (à quelques exceptions près, comme H+). Parmi le reste, il est extrêmement rare de considérer un cation dérivé d'un élément non métallique.
On verra que beaucoup d'entre eux sont di ou polyvalents, et que l'ampleur de leurs charges concorde avec le nombre de leurs groupes dans le tableau périodique..
-Li+
-N / A+
-K+
-Rb+
-Cs+
-Fr+
-Ag+
Tous ont en commun la charge «1+», qui s'écrit sans qu'il soit nécessaire de mettre le numéro, et proviennent également du groupe 1: les métaux alcalins. En outre, il y a le cation Ag+, l'un des métaux de transition les plus courants.
-Êtredeux+
-Mgdeux+
-ACdeux+
-mdeux+
-Badeux+
-Radeux+
Ces cations bivalents sont dérivés de leurs métaux respectifs appartenant au groupe 2: les métaux alcalino-terreux..
-Au3+
-Géorgie3+
-Dans3+
-Tl3+
-Nh3+
Cations trivalents du groupe bore.
Jusqu'à présent, les exemples ont été caractérisés comme ayant une seule valence ou charge. D'autres cations présentent plus d'une valence ou un état d'oxydation positif:
-Sndeux+
-Sn4+ (étain)
-Codeux+
-Co3+ (cobalt)
-Au+
-Au3+ (or)
-Foideux+
-Foi3+ (fer)
Et d'autres métaux, comme le manganèse, peuvent avoir encore plus de valences:
-Mndeux+
-Mn3+
-Mn4+
-Mn7+
Plus la charge est élevée, plus le cation est petit et polarisant..
Polyatomique
Sans entrer dans la chimie organique, il existe des cations inorganiques et polyatomiques très courants dans la vie quotidienne; comme:
-H3OU ALORS+ (hydronium, déjà mentionné).
-NH4+ (ammonium).
-NE PASdeux+ (nitronium, présent dans les processus de nitration).
-PH4+ (phosphonium).
Les références
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Helmenstine, Anne Marie, Ph.D. (05 mai 2019). Définition et exemples de cations. Récupéré de: thinkco.com
- Wyman Elizabeth. (2019). Cation: définition et exemples. Étude. Récupéré de: study.com
- Nuls. (2019). Ions positifs et négatifs: cations et anions. Récupéré de: dummies.com
- Wikipédia. (2019). Cation. Récupéré de: es.wikipedia.org

Personne n'a encore commenté ce post.