
Structure, propriétés, risques, utilisations du cyanure de sodium (NaCN)

le Le cyanure de sodium est un sel inorganique formé par un cation sodium Na+ et un anion cyanure CN-. Sa formule chimique est NaCN. Aussi connu sous le nom de cyanure de sodium, c'est un solide cristallin blanc. Il est hygroscopique, c'est-à-dire qu'il absorbe l'eau de l'environnement et ses cristaux sont cubiques comme le chlorure de sodium NaCl.
Lorsqu'il est dissous dans l'eau, il a tendance à former du cyanure d'hydrogène HCN. Ses solutions dissolvent facilement l'or et l'argent. Cette caractéristique le rend utilisé pour extraire l'or et l'argent de ses minéraux. Les solutions utilisées à cet effet sont recyclées, c'est-à-dire qu'elles sont réutilisées plusieurs fois.

Cependant, une partie du cyanure parvient à s'échapper vers certains bassins de déchets, ce qui représente un danger pour la faune et l'homme, car le cyanure est très toxique et peut entraîner la mort..
Le NaCN est utilisé dans l'industrie chimique comme intermédiaire pour préparer divers types de composés, tels que des colorants, des produits chimiques agricoles et des médicaments ou des médicaments..
Le cyanure de sodium est un composé très dangereux car il peut entraîner la mort, il doit donc être manipulé avec une extrême prudence.
Index des articles
- 1 Structure
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Point de fusion
- 3.4 Point d'ébullition
- 3.5 Point d'éclair
- 3.6 Densité
- 3.7 Solubilité
- 3.8 Constante de dissociation
- PH 3,9
- 3.10 Propriétés chimiques
- 4 risques
- 5 Obtention
- 6 utilisations
- 6.1 Dans l'extraction des minéraux d'or et d'argent. Conséquences
- 6.2 Dans la production d'autres composés chimiques
- 6.3 Dans l'industrie métallurgique
- 6.4 Dans d'autres utilisations
- 6.5 Applications hors d'usage, douteuses ou très rares
- 7 Références
Structure
Le cyanure de sodium est composé d'un ion Na + et d'un ion CN-.
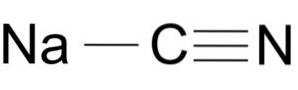
L'ion cyanure a un atome de carbone C et un atome d'azote N liés l'un à l'autre par une triple liaison..
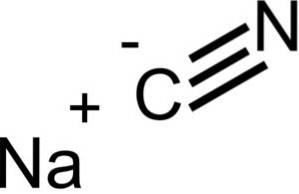
NaCN a la même structure cristalline que NaCl, donc ses cristaux sont cubiques.
Nomenclature
-Le cyanure de sodium
-Le cyanure de sodium
Propriétés
État physique
Solide cristallin blanc hygroscopique (absorbe l'eau de l'environnement).
Poids moléculaire
49,007 g / mol
Point de fusion
563,7 ºC
Point d'ébullition
1496 ºC
Point d'inflammation
Ce n'est pas inflammable. Mais s'ils sont exposés à un incendie, du cyanure d'hydrogène HCN et des oxydes d'azote sont produits..
Densité
1 595 g / cm3 à 20 ºC
Solubilité
Très soluble dans l'eau: 48 g / 100 mL à 10 ° C, 82 g / 100 mL à 35 ° C. Légèrement soluble dans l'alcool
Constante de dissociation
Il est hydrolysé en solution aqueuse générant du cyanure d'hydrogène HCN. La constante de cette hydrolyse est Kh = 2,5 x 10-5.
pH
Les solutions aqueuses de NaCN sont fortement alcalines
Propriétés chimiques
Lorsqu'il est dissous dans l'eau, il se sépare en ses ions Na+ et CN-. En solution aqueuse, l'ion cyanure CN- prendre un proton H+ d'eau HdeuxOu formant HCN et un ion OH-, donc la solution devient alcaline.
CN- + HdeuxO → HCN + OH-
Pour cette raison, ses solutions aqueuses se décomposent rapidement lorsqu'elles sont stockées, formant du cyanure d'hydrogène HCN..
Il est corrosif vis-à-vis de l'aluminium. Ses solutions dissolvent facilement l'or Au et l'argent Ag en présence d'air..
C'est un agent chélatant puisque l'anion cyanure CN- peut facilement se lier à d'autres métaux, tels que l'argent, l'or, le mercure, le zinc, le cadmium, etc..
A une légère odeur d'amande amère.
Des risques
Il doit être manipulé avec beaucoup de soin. C'est un composé hautement toxique, inhibe les processus métaboliques importants et entraîne la mort par ingestion, inhalation, absorption par la peau ou contact avec les yeux..
En cas d'inhalation, le NaCN se dissout dans la muqueuse des voies respiratoires et passe dans la circulation sanguine. L'ion cyanure de NaCN a une forte affinité pour le fer à l'état d'oxydation de +3, c'est-à-dire le cation ferrique Fe3+.
Lorsque le cyanure est absorbé, il réagit rapidement avec Fe3+ d'une enzyme importante des mitochondries des cellules (cytochrome oxydase), empêchant certains processus de la respiration de ce.
Par conséquent, la respiration cellulaire est inhibée ou ralentie et une hypoxie cytotoxique en résulte. Cela signifie que les cellules et les tissus sont incapables d'utiliser l'oxygène, en particulier les cellules cérébrales et cardiaques.
De cette manière, des dommages permanents ou mortels au corps se produisent. Cela peut se produire chez les humains et les animaux..
En cas d'ingestion, il provoque une congestion des vaisseaux sanguins et une corrosion de la muqueuse gastrique, en plus de ce qui précède.

Il n'est pas combustible, mais au contact d'acides, il libère du HCN qui est hautement inflammable et toxique.
S'il fond avec des nitrites ou des chlorates, il peut exploser.
Obtention
Peut être obtenu avec du sodium Na, de l'ammoniaque NH3 et le carbone C. Le sodium réagit avec l'ammoniac pour donner l'amidure de sodium NaNHdeux:
2 Na + 2 NH3 → 2 NaNHdeux + Hdeux↑
L'amide de sodium est chauffé avec du charbon de bois à 600 ° C et produit du cyanamide de sodium NadeuxNCN, qui est ensuite converti en cyanure de sodium avec du charbon de bois à 800 ºC:
2 NaNHdeux + C → 2 Hdeux↑ + NadeuxNCN
N / AdeuxNCN + C → 2 NaCN
Une autre méthode consiste à faire fondre le cyanamide de calcium CaNCN et le carbone C avec du carbonate de sodium NadeuxCO3:
CaNCN + C + NadeuxCO3 → CaCO3 + 2 NaCN
Il peut également être préparé en faisant passer de l'azote gazeux Ndeux par un mélange chaud de carbonate de sodium NadeuxCO3 et du carbone C en poudre, utilisant le fer Fe comme catalyseur ou accélérateur de réaction:
N / AdeuxCO3 + 4 C + Ndeux → 2 NaCN + 3 CO ↑
Applications
Dans l'extraction des minéraux d'or et d'argent. Conséquences
Le cyanure de sodium a longtemps été utilisé pour extraire les métaux or et argent de leurs minerais..
Le cyanure utilisé dans le processus est recyclé, mais quelque chose s'échappe dans le bassin de déchets avec les métaux lourds non récupérés.
Des oiseaux, des chauves-souris et d'autres animaux qui boivent dans ces lagunes de cyanure ont été empoisonnés.
Il existe des enregistrements d'un barrage en Roumanie qui a isolé un bassin de déchets et a été endommagé par un événement météorologique..
En conséquence, des tonnes de cyanure ont été rejetées dans le fleuve Sasar et les systèmes aquifères voisins tels que les rivières Lapus, Somes et Tisza, se terminant dans le Danube..
Cela a provoqué une cascade de morts d'animaux, ou en d'autres termes, une catastrophe écologique..

Dans la production d'autres composés chimiques
Le cyanure de sodium NaCN est utilisé dans la synthèse de divers types de composés organiques.
Par exemple, des pigments et des colorants (y compris des azurants optiques), des composés à utiliser dans l'agriculture ou des produits agrochimiques et divers produits pharmaceutiques sont préparés..
Il est également utilisé pour obtenir des agents chélateurs ou séquestrants d'ions métalliques..
Les composés appelés nitriles sont préparés avec du cyanure de sodium NaCN, qui, lorsqu'ils sont traités avec une solution aqueuse acide ou alcaline chaude, permettent d'obtenir des acides carboxyliques.
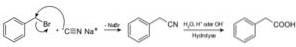
Il permet de préparer des acides gras avec des groupes cyano, des cyanures de métaux lourds et de l'acide cyanhydrique ou du cyanure d'hydrogène HCN.
Dans l'industrie métallurgique
NaCN est utilisé dans les solutions utilisées dans la galvanoplastie ou la galvanoplastie de métaux (revêtement de métaux avec d'autres), par exemple le zinc.
C'est un composant d'acier trempé. Sert également au nettoyage des métaux.
Dans d'autres utilisations
Le cyanure de sodium est un intermédiaire dans la fabrication du nylon.
Sert à la séparation des minéraux par flottation de mousse.
Applications hors d'usage, remises en question ou très rares
NaCN a été utilisé pour tuer les rongeurs, tels que les lapins et les rats, et leurs terriers, et pour tuer les nids de termites.
Actuellement, il est utilisé occasionnellement pour éliminer les coyotes, les renards et les chiens sauvages. Utilisé sous forme de capsule en doses uniques ou multiples sur les parcours, les terrains de chasse et les forêts.
En raison de son extrême toxicité, le NaCN ne doit être utilisé que par des personnes formées..
Cette utilisation est considérée comme très dangereuse pour l'homme, mais il y a ceux qui l'utilisent encore.

En agriculture, il était autrefois utilisé pour fumiger les agrumes et autres fruits. Il était également utilisé comme insecticide et acaricide (anti-acarien) à appliquer après la récolte, pour les agrumes non stockés ou pour la fumigation des camions utilisés pour les transporter. Il était également utilisé pour fumiger les navires, les wagons et les entrepôts..
Toutes ces utilisations ont été remises en question en raison de la forte toxicité du cyanure de sodium. Pour cette raison, il n'est plus utilisé ou très rarement et dans des conditions très contrôlées..
Les références
- NOUS. Bibliothèque nationale de médecine. (2019). Le cyanure de sodium. Récupéré de pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyclopédie de la technologie chimique. Quatrième édition. John Wiley et fils.
- Hurst, S.E. et Martin, M.D. (2017). Toxicologie. Cyanure. En pharmacologie et thérapeutique pour la dentisterie (septième édition). Récupéré de sciencedirect.com.
- Coppock et R.W. et Dziwenka, M. (2015). Menaces pour la faune par les agents de guerre chimique. In Handbook of Toxicology of Chemical Warfare Agents (deuxième édition). Récupéré de sciencedirect.com.
- Morrison et R.T. et Boyd, R.N. (2002). Chimie organique. 6e édition. Prentice Hall.


Personne n'a encore commenté ce post.