
Structure, propriétés, utilisations et synthèse du cyclobutane

le cyclobutane est un hydrocarbure constitué d'un cycloalcane à quatre carbones, dont la formule moléculaire est C4H8. Il peut également être appelé tétraméthylène, étant donné qu'il s'agit de quatre unités CHdeux qui composent un anneau à géométrie carrée, bien que le nom cyclobutane soit plus accepté et connu.
À température ambiante, c'est un gaz incolore et inflammable qui brûle avec une flamme vive. Son utilisation la plus primitive est comme source de chaleur lors de sa combustion; Cependant, sa base structurelle (le carré) englobe des aspects biologiques et chimiques profonds, et collabore d'une certaine manière avec les propriétés de ces composés..
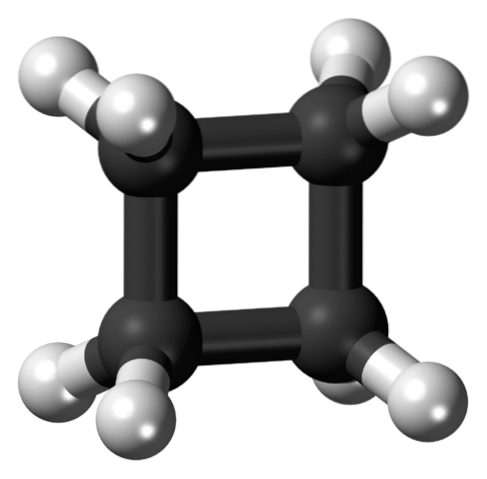
L'image du haut montre une molécule de cyclobutane avec une structure carrée. Dans la section suivante, nous expliquerons pourquoi cette conformation est instable, puisque ses liens sont tendus..
Après le cyclopropane, c'est le cycloalcane le plus instable, car plus la taille du cycle est petite, plus il sera réactif. Selon cela, le cyclobutane est plus instable que les cycles du pentane et de l'hexane. Cependant, il est curieux d'assister dans ses dérivés à un noyau ou cœur carré, qui, comme on le verra, est dynamique.
Index des articles
- 1 Structure du cyclobutane
- 1.1 Conformations papillon ou plissées
- 1.2 Interactions intermoléculaires
- 2 propriétés
- 2.1 Apparence physique
- 2.2 Masse moléculaire
- 2.3 Point d'ébullition
- 2.4 Point de fusion
- 2.5 Point d'éclair
- 2.6 Solubilité
- 2.7 Densité
- 2.8 Densité de vapeur
- 2.9 Pression de vapeur
- 2.10 Indice de réfraction
- 2.11 Enthalpie de combustion
- 2.12 Chaleur de formation
- 3 Synthèse
- 4 utilisations
- 5 Références
Structure du cyclobutane
Dans la première image, la structure du cyclobutane a été abordée comme un simple carré carbonisé et hydrogéné. Cependant, dans ce carré parfait, les orbitales subissent une torsion sévère par rapport à leurs angles d'origine: elles sont séparées d'un angle de 90 ° contre 109,5 ° pour un atome de carbone avec hybridation sp.3 (contrainte angulaire).
Atomes de carbone sp3 ils sont tétraédriques, et pour certains tétraèdres, il serait difficile de fléchir autant leurs orbitales pour créer un angle de 90 °; mais ce serait encore plus le cas pour les carbones avec des hybridations spdeux (120 °) et sp (180 °) dévient de leurs angles d'origine. Pour cette raison, le cyclobutane a sp atomes de carbone3 en essence.
De plus, les atomes d'hydrogène sont très proches les uns des autres, éclipsés dans l'espace. Il en résulte une augmentation de l'encombrement stérique, ce qui affaiblit le carré supposé en raison de sa forte contrainte de torsion..
Par conséquent, les contraintes angulaires et de torsion (encapsulées dans le terme «contrainte annulaire») rendent cette conformation instable dans des conditions normales..
La molécule de cyclobutane cherchera à réduire les deux contraintes, et pour y parvenir, elle adopte ce que l'on appelle la conformation papillon ou plissé..
Papillon ou conformations froissées
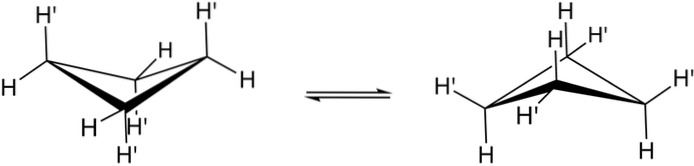
Les vraies conformations du cyclobutane sont indiquées ci-dessus. En eux, les contraintes angulaires et de torsion diminuent; puisque, comme on peut le voir, maintenant tous les atomes d'hydrogène ne sont pas éclipsés. Cependant, il y a un coût énergétique: l'angle de ses maillons est aiguisé, c'est-à-dire qu'il passe de 90 à 88 °.
Notez qu'il peut être comparé à un papillon, dont les ailes triangulaires sont constituées de trois atomes de carbone; et le quatrième, positionné à un angle de 25 ° par rapport à chaque aile. Les flèches bidirectionnelles indiquent qu'il existe un équilibre entre les deux conformères. C'est comme si le papillon descendait et levait ses ailes.
Dans les dérivés de cyclobutane, par contre, on s'attend à ce que ce battement soit beaucoup plus lent et spatialement gêné..
Interactions intermoléculaires
Supposons que vous oubliez les carrés pendant un moment et qu'ils soient remplacés par des papillons gazéifiés à la place. Ceux-ci dans leur battement ne peuvent être maintenus ensemble dans le liquide que par les forces de dispersion de Londres, qui sont proportionnelles à la surface de leurs ailes et à leur masse moléculaire..
Propriétés
Apparence physique
Gaz incolore.
Masse moléculaire
56,107 g / mol.
Point d'ébullition
12,6 ° C Par conséquent, dans des conditions froides, il pourrait être manipulé en principe comme n'importe quel liquide; avec le seul détail, qu'il serait très volatil, et ses vapeurs représenteraient encore un risque à prendre en compte.
Point de fusion
-91 ° C.
point d'allumage
Verre fermé à 50 ° C.
Solubilité
Insoluble dans l'eau, ce qui n'est pas surprenant compte tenu de son caractère non polaire; mais, il est légèrement soluble dans les alcools, l'éther et l'acétone, qui sont des solvants moins polaires. On s'attend à ce qu'il soit soluble (bien que non signalé) logiquement dans les solvants apolaires tels que le tétrachlorure de carbone, le benzène, le xylène, etc..
Densité
0,7125 à 5 ° C (par rapport à 1 de l'eau).
Densité de vapeur
1,93 (par rapport à 1 de l'air). Cela signifie qu'il est plus dense que l'air, et par conséquent, à moins qu'il n'y ait de courants, sa tendance ne sera pas de monter..
La pression de vapeur
1180 mmHg à 25 ° C.
Indice de réfraction
1,3625 à 290 ° C.
Enthalpie de combustion
-655,9 kJ / mol.
Chaleur de formation
6,6 Kcal / mol à 25 ° C.
La synthèse
Le cyclobutane est synthétisé par hydrogénation du cyclobutadiène, dont la structure est presque la même, à la seule différence qu'il a une double liaison; et donc il est encore plus réactif. C'est peut-être la voie synthétique la plus simple pour l'obtenir, ou du moins seulement vers elle et non vers un dérivé.
Dans le pétrole brut, il est peu probable de l'obtenir car il finirait par réagir de manière à rompre l'anneau et à former la chaîne linéaire, c'est-à-dire le n-butane..
Une autre méthode pour obtenir du cyclobutane consiste à frapper un rayonnement ultraviolet sur les molécules d'éthylène, CHdeux= CHdeux, qui se dimérisent. Cette réaction est favorisée photochimiquement, mais pas thermodynamiquement:
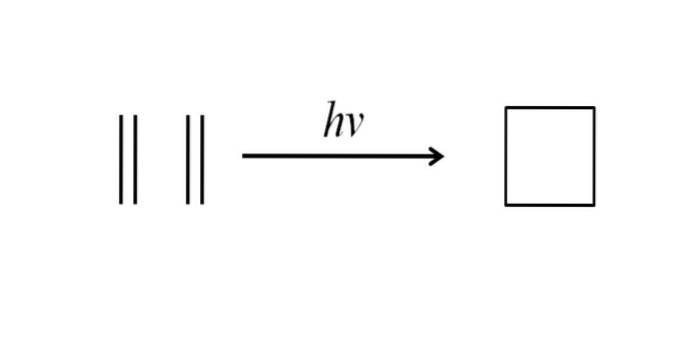
L'image ci-dessus résume très bien ce qui a été dit dans le paragraphe ci-dessus. Si, au lieu de l'éthylène, on avait, par exemple, deux alcènes quelconques, un cyclobutane substitué serait obtenu; ou ce qui est pareil, un dérivé du cyclobutane. En fait, de nombreux dérivés aux structures intéressantes ont été synthétisés par cette méthode..
D'autres dérivés, cependant, impliquent une série d'étapes de synthèse compliquées. Par conséquent, les cyclobutanes (comme leurs dérivés sont appelés) font l'objet d'études pour les synthèses organiques..
Applications
Le cyclobutane seul n'a d'autre utilité que de servir de source de chaleur; mais ses dérivés entrent dans un terrain complexe de la synthèse organique, avec des applications en pharmacologie, biotechnologie et médecine. Sans se plonger dans des structures trop complexes, les pénitrèmes et le grandisol sont des exemples de cyclobutanes.
Les cyclobutanes ont généralement des propriétés bénéfiques pour le métabolisme des bactéries, des plantes, des invertébrés marins et des champignons. Ils sont biologiquement actifs, c'est pourquoi leurs usages sont très variés et difficiles à préciser, car chacun a son effet particulier sur certains organismes..
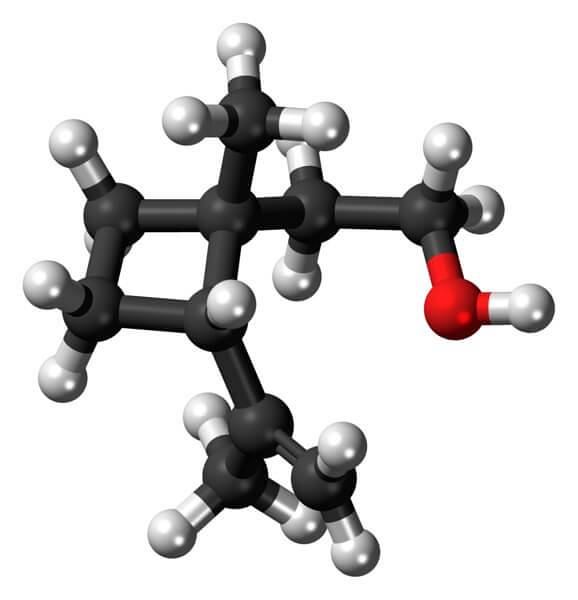
Le grandisol, par exemple, est une phéromone du charançon (un type de coléoptère). Ci-dessus, et enfin, sa structure est représentée, considérée comme un monoterpène à base carrée de cyclobutane.
Les références
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Solomons, T.W.; Craig B. Fryhle. (2011). Chimie organique. (Onzee édition). Wiley.
- Wikipédia. (2019). Cyclobutane. Récupéré de: en.wikipedia.org
- PubChem. (2019). Cyclobutane. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Peiris Nicole. (2015, 29 novembre). Propriétés physiques des cycloalcanes. Chimie LibreTexts. Récupéré de: chem.libretexts.org
- Wiberg B. Kenneth. (2005). Propriétés physiques du cyclobutane et études théoriques. Département de chimie, Université de Yale.
- Klement Foo. (s.f.). Cyclobutanes en synthèse organique. Récupéré de: scripps.edu
- Myers. (s.f.). Synthèse des cyclobutanes. Chem 115. Récupéré de: hwpi.harvard.edu


Personne n'a encore commenté ce post.