
Propriétés, risques et utilisations de l'acide bromique (HBrO3)
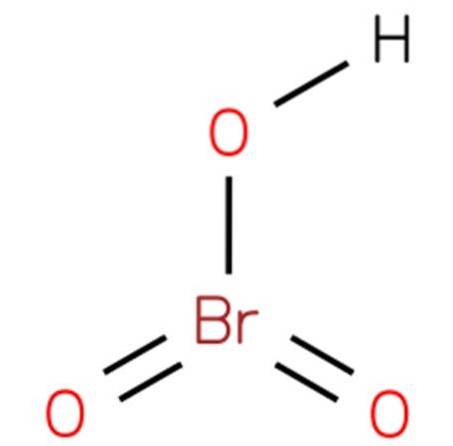
le acide bromique, Aussi connu sous le nom de bromate d'hydrogène ou d'acide bromique (V), c'est un composé chimique de formule HBrO3. C'est un oxacide de brome avec une structure analogue à l'acide chlorique (EMBL-EBI, 2014). Le composé est un acide très fort. Sa structure est présentée dans la figure 1 (EMBL-EBI, 2008).
Pour préparer l'acide bromique, un bromate soluble est généralement dissous dans l'eau et un sel de baryum soluble est ajouté. Le bromate de baryum faiblement soluble précipite.
Le bromate de baryum peut ensuite être dissous dans l'eau et acidifié avec de l'acide sulfurique pour précipiter le sulfate de baryum essentiellement insoluble et laisser l'acide bromique derrière (voir image ci-dessus):
2KBrO3 (aq) + BaCl2 (aq) -> Ba (BrO3) 2 (s) + 2KCl (aq)
Ba (BrO3) 2 (aq) + H2SO4 (aq) -> 2HBrO3 + BaSO4
Le composé peut également être produit par décomposition du pentachlorure de brome en solution alcaline selon la réaction:
BrCl5 + 3 H2O → HBrO3 + 5 HCl
L'acide bromique est un agent oxydant puissant. L'ion bromate peut être davantage oxydé avec du fluor élémentaire ou du difluorure de xénon en présence de base, une oxydation accompagnée de petites explosions et le tube en téflon a pris feu (My Favorite Chemicals, S.F.).
Index des articles
- 1 Propriétés physiques et chimiques de l'acide bromique
- 2 Réactivité et dangers
- 2.1 En cas de contact avec les yeux
- 2.2 En cas de contact cutané
- 2.3 En cas d'inhalation
- 3 utilisations
- 4 Références
Propriétés physiques et chimiques de l'acide bromique
L'acide bromique n'existe qu'en solution incolore (jusqu'à 50% p / v) qui vire au jaunâtre au contact de l'air (National Center for Biotechnology Information., 2017). Son apparence est illustrée à la figure 2.

Le composé a un poids moléculaire de 128,91 g / mol et se décompose à 100 ° C et a un pKa de -2. Étant un composé instable, ses propriétés physico-chimiques ont été obtenues grâce à des calculs informatiques..
Il a un point de fusion de 206,04 ° C, un point d'ébullition de 517,26 ° C et une solubilité dans l'eau de 1 x 106 mg / l à 25 ° C (Royal Society of Chemistry, 2015).
Le composé est un agent oxydant puissant. Lorsqu'il est mélangé avec de l'éthanol ou de l'éther, il se décompose pour former de l'acide acétique dans une réaction exothermique. Il est essentiel pour l'élaboration de sels de bromate (BrO3-) qui sont préparés en faisant réagir des carbonates ou des oxydes métalliques avec de l'acide bromique (Watts, 1870).
Réactivité et dangers
L'acide bromique est un composé instable qui se décompose en brome élémentaire. Étant un acide fort, il est extrêmement dangereux en cas de contact avec la peau (corrosif et irritant), en contact avec les yeux (irritant) et en cas d'ingestion. Très dangereux aussi, en cas d'inhalation.
Une surexposition sévère peut provoquer des lésions pulmonaires, une suffocation, une perte de conscience ou la mort. Une exposition prolongée peut provoquer des brûlures et des ulcérations cutanées. Une surexposition par inhalation peut provoquer une irritation respiratoire..
L'inflammation de l'œil se caractérise par une rougeur, un larmoiement et des démangeaisons. L'inflammation de la peau est caractérisée par des démangeaisons, une desquamation, des rougeurs et parfois des cloques.
La substance est toxique pour les reins, les poumons et les muqueuses. Une exposition répétée ou prolongée à la substance peut provoquer des lésions de ces organes..
En cas de contact avec les yeux
Vérifiez si des lentilles de contact sont portées et retirez-les immédiatement. Les yeux doivent être rincés à l'eau courante pendant au moins 15 minutes, en gardant les paupières ouvertes. De l'eau froide peut être utilisée. La pommade oculaire ne doit pas être utilisée.
En cas de contact cutané
Si le produit chimique entre en contact avec les vêtements, retirez-le le plus rapidement possible, en protégeant vos mains et votre corps. Placer la victime sous une douche de sécurité.
Si le produit chimique s'accumule sur la peau exposée de la victime, comme les mains, la peau contaminée est lavée doucement et soigneusement à l'eau courante et au savon non abrasif. De l'eau froide peut être utilisée. Si l'irritation persiste, consulter un médecin. Lavez les vêtements contaminés avant de les réutiliser.
Si le contact avec la peau est sévère, elle doit être lavée avec un savon désinfectant et recouvrir la peau contaminée d'une crème antibactérienne..
En cas d'inhalation
Il est conseillé de laisser la victime se reposer dans un endroit bien ventilé. Si l'inhalation est sévère, la victime doit être évacuée vers une zone sûre dès que possible. Desserrez les vêtements serrés comme un col de chemise, une ceinture ou une cravate. Si la victime a du mal à respirer, de l'oxygène doit être administré.
Si la victime ne respire pas, une réanimation bouche-à-bouche est effectuée. Gardez toujours à l'esprit qu'il peut être dangereux pour la personne aidant de pratiquer la réanimation bouche-à-bouche lorsque le produit inhalé est toxique, infectieux ou corrosif..
En cas d'ingestion, ne pas faire vomir. Desserrez les vêtements serrés tels que les cols de chemises, les ceintures ou les cravates. Si la victime ne respire pas, effectuez une réanimation bouche-à-bouche.
Dans tous les cas, consultez immédiatement un médecin..
Applications
L'acide bromique est utilisé comme agent oxydant puissant dans les réactions de laboratoire. Il est utilisé pour produire des composés chimiques tels que les iodates, l'acide chlorique, l'acide tétraihonique entre autres..
Il est également utilisé pour la production de bromates tels que le fer, le plomb, le manganèse et le bromate de mercure, entre autres..
L'acide bromique agit comme un intermédiaire important dans la réaction Bélousov-Zhabotinsky (Morris, 2010). Cette réaction est un exemple d'horloges chimiques et illustre une réaction de non-équilibre thermodynamique.
La réaction d'oscillation est catalysée par le cérium et est intrinsèquement liée à la chimie des oxoacides de brome HBrOx. L'intérêt croissant pour les systèmes chimiques non linéaires a fortement incité à étudier la chimie du brome..
Dans la réaction de Belousov-Zhabotinsky, les composés bromés impliqués sont l'acide hypobromeux HOBr, l'acide bromique HOBrO et l'acide bromique HBrO3 (3) (Rainer Glaser, 2013).
Ces types de réactions sont importants pour la chimie théorique. Ils montrent que les réactions chimiques ne doivent pas être dominées par un comportement thermodynamique à l'équilibre.
Les références
- Acide bromique. (S.F.). Récupéré de chemyq.com.
- EMBL-EBI. (2008, 16 mai). acide bromique. Récupéré de ebi.ac.uk.
- EMBL-EBI. (2014, 28 juillet). acide chlorique. Récupéré de ebi.ac.uk.
- Morris, S. (23 janvier 2010). Réaction de Belousov Zhabotinsky 8 x vitesse normale. Récupéré de youtubecom.
- Mes produits chimiques préférés. (S.F.). Récupéré de bromicacid.com.
- Centre national d'information sur la biotechnologie. (2017, 11 mars). Base de données des composés PubChem; CID = 24445 ,. Récupéré de PubChem.
- Rainer Glaser, M. D. (2013). Pourquoi l'acidité de l'acide bromique est vraiment importante pour les modèles cinétiques des réactions chimiques oscillantes de Belousov-Zhabotinsky. Journal of Thermodynamics & Catalysis 4: 1.
- Société royale de chimie. (2015). Acide bromique. Récupéré de chemspider.com.
- Watts, H. (1870). Un dictionnaire de chimie et branches connexes d'autres sciences, volume 1. Londres: longmans, vert et co.



Personne n'a encore commenté ce post.