
Structure, propriétés, synthèse, utilisations de l'acide carbonique (H2CO3)
le acide carbonique C'est un composé inorganique, bien que certains débattent du fait qu'il soit en fait organique, dont la formule chimique est HdeuxCO3. C'est donc un acide diprotique, capable de donner deux ions H+ au milieu aqueux pour générer deux cations moléculaires H3OU ALORS+. De là découlent les ions bicarbonate bien connus (HCO3-) et carbonate (CO3deux-).
Cet acide particulier, simple, mais en même temps impliqué dans des systèmes où de nombreuses espèces participent à un équilibre liquide-vapeur, est formé de deux molécules inorganiques fondamentales: l'eau et le dioxyde de carbone. La présence de COdeux non dissous est observé chaque fois qu'il y a un bouillonnement dans l'eau, remontant vers la surface.

Ce phénomène est observé très régulièrement dans les boissons gazeuses et les eaux gazeuses..
Dans le cas de l'eau gazeuse ou gazeuse (image ci-dessus), une telle quantité de CO a été dissoutedeux que sa pression de vapeur est plus du double de celle de la pression atmosphérique. Lorsqu'il n'est pas bouché, la différence de pression à l'intérieur de la bouteille et à l'extérieur diminue la solubilité du COdeux, donc les bulles apparaissent qui finissent par s'échapper du liquide.
Dans une moindre mesure, la même chose se produit dans tout corps d'eau douce ou saline: lorsqu'ils sont chauffés, ils libèrent leur teneur en CO dissous.deux.
Cependant, le COdeux Il n'est pas seulement dissous, mais subit des transformations dans sa molécule qui en font HdeuxCO3; un acide qui a une durée de vie trop courte, mais suffisante pour marquer un changement mesurable du pH de son milieu solvant aqueux, et également générer un système tampon carbonate unique.
Index des articles
- 1 Structure
- 1.1 Molécule
- 1.2 Interactions moléculaires
- 1.3 Acide carbonique pur
- 2 propriétés
- 3 Synthèse
- 3.1 Dissolution
- 3.2 Équilibre liquide-vapeur
- 3.3 Solide pur
- 4 utilisations
- 5 risques
- 6 Références
Structure
Molécule
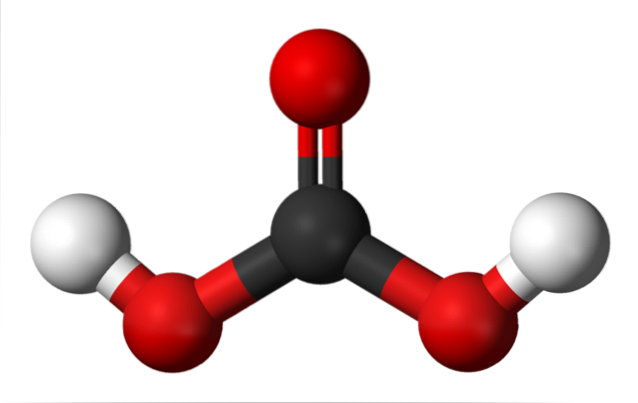
Au-dessus, nous avons la molécule HdeuxCO3, représenté avec des sphères et des barres. Les sphères rouges correspondent aux atomes d'oxygène, le noir à l'atome de carbone et le blanc aux atomes d'hydrogène.
Notez qu'à partir de l'image, vous pouvez écrire une autre formule valide pour cet acide: CO (OH)deux, où CO devient le groupe carbonyle, C = O, lié à deux groupes hydroxyle, OH. Puisqu'il y a deux groupes OH, capables de donner leurs atomes d'hydrogène, on comprend maintenant d'où viennent les ions H+ relâché au milieu.
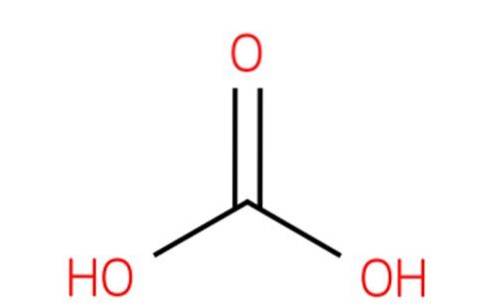
Notez également que la formule CO (OH)deux peut être écrit OHCOOH; c'est-à-dire du type RCOOH, où R est dans ce cas un groupe OH.
C'est pour cette raison, en plus du fait que la molécule est composée d'atomes d'oxygène, d'hydrogène et de carbone, trop courants en chimie organique, que l'acide carbonique est considéré par certains comme un composé organique. Cependant, dans la section sur sa synthèse, on expliquera pourquoi d'autres le considèrent comme étant de nature inorganique et non organique..
Interactions moléculaires
De la molécule HdeuxCO3 On peut dire que sa géométrie est un plan trigonal, le carbone étant situé au centre du triangle. Dans deux de ses sommets, il a des groupes OH, qui sont des donneurs de liaisons hydrogène; et dans l'autre restant, un atome d'oxygène du groupe C = O, accepteur de liaisons hydrogène.
Ainsi, le HdeuxCO3 a une forte tendance à interagir avec des solvants protiques ou oxygénés (et azotés).
Et par coïncidence, l'eau répond à ces deux caractéristiques, et telle est l'affinité de HdeuxCO3 pour elle qui lui donne presque immédiatement un H+ et un équilibre d'hydrolyse commence à être établi qui implique l'espèce HCO3- et H3OU ALORS+.
C'est pourquoi la simple présence d'eau décompose l'acide carbonique et rend son isolement en tant que composé pur trop compliqué..
Acide carbonique pur
Revenons à la molécule HdeuxCO3, non seulement il est plat, capable de liaison hydrogène, mais il peut également présenter une isomérie cis-trans; C'est, dans l'image, nous avons l'isomère cis, avec les deux H pointant dans la même direction, tandis que dans l'isomère trans, ils pointeraient dans des directions opposées.
L'isomère cis est le plus stable des deux, c'est pourquoi c'est le seul qui est généralement représenté.
Un solide pur de HdeuxCO3 Il se compose d'une structure cristalline composée de couches ou de nappes de molécules interagissant avec des liaisons hydrogène latérales. C'est à prévoir, avec la molécule HdeuxCO3 plat et triangulaire. Lorsqu'ils sont sublimés, les dimères cycliques (HdeuxCO3)deux, qui sont reliés par deux liaisons hydrogène C = O - OH.
La symétrie des cristaux HdeuxCO3 n'a pas été en mesure de définir pour le moment. Il a été considéré comme cristallisant sous forme de deux polymorphes: α-HdeuxCO3 et β-HdeuxCO3. Cependant, α-HdeuxCO3, synthétisé à partir d'un mélange de CH3COOH-COdeux, il s'est avéré être en fait CH3OCOOH: un ester monométhylique d'acide carbonique.
Propriétés
Il a été mentionné que le HdeuxCO3 c'est un acide diprotique, il peut donc donner deux ions H+ à un support qui les accepte. Lorsque ce milieu est de l'eau, les équations de sa dissociation ou de son hydrolyse sont:
HdeuxCO3(ac) + HdeuxO (l) <=> HCO3-(ac) + H3OU ALORS+(ac) (Ka1 = 2,5 × 10−4)
HCO3-(ac) + HdeuxO (l) <=> CO3deux-(ac) + H3OU ALORS+(ac) (Kadeux = 4,69 × 10−11)
Le HCO3- est l'anion bicarbonate ou hydrogénocarbonate, et le CO3deux- l'anion carbonate. Sont également indiquées leurs constantes d'équilibre respectives, Ka1 et Kadeux. Être Kadeux cinq millions de fois plus petit que Ka1, la formation et la concentration de CO3deux- ils sont méprisables.
Ainsi, même s'il s'agit d'un acide diprotique, le deuxième H+ il peut à peine le libérer de manière appréciable. Cependant, la présence de COdeux dissous en grandes quantités, il suffit d'acidifier le milieu; dans ce cas, l'eau, abaissant ses valeurs de pH (en dessous de 7).
Parler d'acide carbonique, c'est se référer pratiquement à une solution aqueuse où les espèces HCO prédominent3- et H3OU ALORS+; il ne peut pas être isolé par des méthodes conventionnelles, car la moindre tentative modifierait l'équilibre de la solubilité du COdeux à la formation de bulles qui s'échapperaient de l'eau.
La synthèse
Dissolution
L'acide carbonique est l'un des composés les plus faciles à synthétiser. Comment? La méthode la plus simple consiste à faire bouillonner, à l'aide d'une paille ou d'une paille, l'air que nous expirons dans un volume d'eau. Parce que nous expirons essentiellement du COdeux, Cela bouillonnera dans l'eau, en dissolvant une petite partie.
Lorsque nous faisons cela, la réaction suivante se produit:
COdeux(g) + HdeuxO (l) <=> HdeuxCO3(ac)
Mais à son tour, la solubilité du CO doit être prise en compte.deux dans l'eau:
COdeux(g) <=> COdeux(ac)
Le COdeux comme le HdeuxO sont des molécules inorganiques, donc les HdeuxCO3 il est inorganique de ce point de vue.
Équilibre liquide-vapeur
En conséquence, nous avons un système en équilibre qui dépend fortement des pressions partielles de COdeux, ainsi que la température du liquide.
Par exemple, si la pression de COdeux augmente (dans le cas où nous soufflons l'air avec plus de force à travers la paille), plus de H se formeradeuxCO3 et le pH deviendra plus acide; puisque le premier équilibre se déplace vers la droite.
Par contre, si nous chauffons la solution de HdeuxCO3, cela diminuera la solubilité du COdeux dans l'eau car c'est un gaz, et l'équilibre se déplacera alors vers la gauche (il y aura moins de HdeuxCO3). Il en sera de même si nous essayons d'appliquer un vide: le COdeux il s'échappera ainsi que les molécules d'eau, ce qui déplacerait à nouveau l'équilibre vers la gauche.
Solide pur
Ce qui précède nous permet de parvenir à une conclusion: à partir d'une solution de HdeuxCO3 il n'y a aucun moyen de synthétiser cet acide sous forme de solide pur par une méthode conventionnelle. Cependant, cela se fait, depuis les années 90 du siècle dernier, à partir de mélanges solides de COdeux et HdeuxOU ALORS.
À ce mélange solide COdeux-HdeuxOu à 50%, il est bombardé de protons (un type de rayonnement cosmique), de sorte qu'aucun des deux composants ne s'échappe et la formation de H se produitdeuxCO3. Un mélange de CH a également été utilisé à cet effet.3OH-COdeux (rappelez-vous α-HdeuxCO3).
Une autre méthode consiste à faire la même chose mais en utilisant directement de la glace sèche, rien de plus..
Des trois méthodes, les scientifiques de la NASA ont pu parvenir à une conclusion: l'acide carbonique pur, solide ou gazeux, peut exister dans les satellites glacés de Jupiter, dans les glaciers martiens et dans les comètes, où ces mélanges solides sont constamment irradiés par les rayons cosmiques..
Applications
L'acide carbonique en lui-même est un composé inutile. Cependant, à partir de ses solutions, des tampons basés sur les paires HCO peuvent être préparés.3-/CO3deux- ou HdeuxCO3/ HCO3-.
Grâce à ces solutions et à l'action de l'enzyme anhydrase carbonique, présente dans les globules rouges, le COdeux produit dans la respiration peut être transporté dans le sang vers les poumons, où il est finalement libéré pour être expiré à l'extérieur de notre corps.
Le bouillonnement de COdeux il est utilisé pour donner aux boissons gazeuses la sensation agréable et caractéristique qu'elles laissent dans la gorge en les buvant.
De même, la présence de HdeuxCO3 Il a une importance géologique dans la formation des stalactites calcaires, car il les dissout lentement jusqu'à ce qu'elles soient à l'origine de leurs finitions pointues.
Et d'autre part, ses solutions peuvent être utilisées pour préparer certains bicarbonates métalliques; bien que pour cela, il soit plus rentable et plus facile d'utiliser directement un sel de bicarbonate (NaHCO3, par exemple).
Des risques
L'acide carbonique a une durée de vie si faible dans des conditions normales (ils estiment à environ 300 nanosecondes) qu'il est pratiquement inoffensif pour l'environnement et les êtres vivants. Cependant, comme dit précédemment, cela n'implique pas qu'il ne peut pas générer un changement inquiétant du pH de l'eau de mer, affectant la faune marine..
En revanche, le vrai «risque» se trouve dans la prise d'eau gazeuse, puisque la quantité de COdeux dissous en eux est beaucoup plus élevé que dans l'eau normale. Cependant, et encore une fois, aucune étude n'a montré que boire de l'eau gazeuse représente un risque mortel; s'ils le recommandent même pour jeûner et combattre l'indigestion.
Le seul effet négatif observé chez ceux qui boivent cette eau est la sensation de satiété, car leur estomac se remplit de gaz. En dehors de cela (sans parler des sodas, car ils sont constitués de bien plus que de l'acide carbonique), on peut dire que ce composé n'est pas du tout toxique.
Les références
- Day, R. et Underwood, A. (1989). Chimie analytique quantitative (cinquième éd.). Salle des Prentices PEARSON.
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). Acide carbonique. Récupéré de: en.wikipedia.org
- Danielle Reid. (2019). Acide carbonique: vidéo sur la formation, la structure et l'équation chimique. Étude. Récupéré de: study.com
- Götz Bucher et Wolfram Sander. (2014). Clarifier la structure de l'acide carbonique. Vol.346, Numéro 6209, p. 544-545. DOI: 10.1126 / science.1260117
- Lynn Yarris. (22 octobre 2014). Nouvelles connaissances sur l'acide carbonique dans l'eau. Berkeley Lab. Récupéré de: newscenter.lbl.gov
- Claudia Hammond. (2015, 14 septembre). L'eau gazeuse est-elle vraiment mauvaise pour vous? Récupéré de: bbc.com
- Jurgen Bernard. (2014). Acide carbonique solide et gazeux. Institut de chimie physique. Université d'Innsbruck.


Personne n'a encore commenté ce post.