
Formule d'acide chlorique (HClO3), propriétés, utilisations
le acide chlorique est un composé inorganique de formule HClO3, composé d'un acide oxacide où le chlore a un état d'oxydation +5 avec une structure analogue à l'acide bromique ou à l'acide iodique. C'est un acide fort capable de donner de l'hydrogène à un accepteur ou à une base de Bronsted..
L'acide a été découvert pour la première fois au 17ème siècle, par Johann Rudolf Glauber de Karlstadt am Main, en Allemagne, dans lequel il a utilisé du chlorure de sodium et de l'acide sulfurique pour la préparation de sulfate de sodium dans le processus de Mannheim, libérant du gaz chloré de l'hydrogène, nocif pour l'homme..
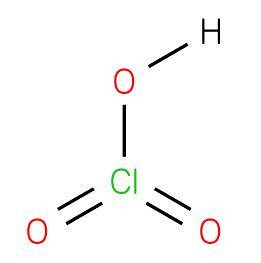
Le composé est obtenu avec du chlorate de baryum (chlorate de barytine) avec de l'acide sulfurique pour produire du sulfate de baryum (Jacob Green, 1829) insoluble dans l'eau selon la réaction suivante:
Ba (ClO3)deux + HdeuxSW4 → 2HClO3 + Baso4
Une autre méthode d'obtention consiste à chauffer l'acide hypochloreux pour obtenir de l'acide chlorique et du chlorure d'hydrogène selon la réaction:
3HClO → HClO3 + 2HCl
L'acide chlorique (HClO3) est un oxydant puissant car il est capable d'être réduit aux états d'oxydation +3, +1 et -1. Il est utilisé pour la fabrication de sels de chlorate.
Il se décompose à des concentrations supérieures à 30%. Il se décompose également lorsqu'il est chauffé, pour cette raison, il doit être conservé au froid tout le temps et tous les bocaux en verre utilisés pour la manipulation doivent être préalablement réfrigérés..
Index des articles
- 1 Propriétés physiques et chimiques
- 1.1 Auto-réactif
- 2 Réactivité et dangers
- 3 utilisations
- 4 Références
Proprietes physiques et chimiques
L'acide chlorique n'existe qu'en solution. C'est un liquide incolore sans arôme caractéristique (National Center for Biotechnology Information, 2017), son aspect est illustré à la figure 2.

Le composé a un poids moléculaire de 84,459 g / mol et une densité de 1 g / ml à environ 25 ° C. Il a un point d'ébullition supérieur à 100 ° C (ACIDE CHLORIQUE, S.F.) et une solubilité dans l'eau de 40 g pour 100 ml de ce solvant à 25 ° C (Royal Society of Chemistry, 2015).
L'acide chlorique accélère la combustion des matériaux combustibles et peut s'enflammer le plus au contact. Le composé est corrosif pour les métaux et les tissus.
Auto-réactif
- Les concentrations d'acide chlorique supérieures à 40% se décomposent.
- Les solutions de sulfure d'antimoine et d'acide chlorique concentré réagissent par incandescence.
- Les solutions de sulfure d'arsenic et d'acide chlorique concentré réagissent par incandescence.
- Réagit vigoureusement, explose même avec d'autres sulfures métalliques, c'est-à-dire le sulfure de cuivre.
- Au contact de matériaux oxydables, dont l'ammoniac, les réactions peuvent être extrêmement violentes..
- Le papier filtre s'allume après l'avoir plongé dans de l'acide chlorhydrique.
- Les explosions ont été enregistrées par des mélanges de solution d'acide chlorique avec des métaux tels que: l'antimoine, le bismuth et le fer. Cela est dû à la formation de composés explosifs, y compris l'hydrogène (ACIDE CHLORIQUE, 2016).
Réactivité et dangers
L'acide chlorique est un composé instable. Étant un acide fort, il est extrêmement dangereux en cas de contact avec la peau (il est corrosif et irritant), en contact avec les yeux (irritant) et en cas d'ingestion. Également très dangereux en cas d'inhalation.
Une surexposition sévère peut provoquer des lésions pulmonaires, une suffocation, une perte de conscience ou la mort. Une exposition prolongée peut provoquer des brûlures cutanées et des ulcérations.
Une surexposition par inhalation peut provoquer une irritation respiratoire. L'inflammation de l'œil se caractérise par une rougeur, un larmoiement et des démangeaisons. L'inflammation de la peau est caractérisée par des démangeaisons, une desquamation, des rougeurs et parfois des cloques.
La substance est toxique pour les reins, les poumons et les muqueuses. Une exposition répétée ou prolongée à la substance peut provoquer des lésions de ces organes..
En cas de contact avec les yeux, vérifiez si vous portez des lentilles de contact et retirez-les immédiatement. Les yeux doivent être rincés à l'eau courante pendant au moins 15 minutes, en gardant les paupières ouvertes. De l'eau froide peut être utilisée. La pommade oculaire ne doit pas être utilisée.
Si le produit chimique entre en contact avec les vêtements, retirez-le le plus rapidement possible, en protégeant vos mains et votre corps. Placer la victime sous une douche de sécurité.
Si le produit chimique s'accumule sur la peau exposée de la victime, comme les mains, la peau contaminée est lavée doucement et soigneusement à l'eau courante et au savon non abrasif..
L'acide peut également être neutralisé avec de l'hydroxyde de sodium dilué ou une base faible telle que le bicarbonate de soude. Si l'irritation persiste, consulter un médecin. Lavez les vêtements contaminés avant de les réutiliser.
Si le contact avec la peau est sévère, elle doit être lavée avec un savon désinfectant et recouvrir la peau contaminée d'une crème antibactérienne..
En cas d'inhalation, la victime doit être autorisée à se reposer dans un endroit bien ventilé. Si l'inhalation est sévère, la victime doit être évacuée vers une zone sûre dès que possible..
Desserrez les vêtements serrés comme un col de chemise, une ceinture ou une cravate. Si la victime a du mal à respirer, de l'oxygène doit être administré. Si la victime ne respire pas, une réanimation bouche-à-bouche est effectuée.
Toujours en tenant compte du fait qu'il peut être dangereux pour la personne qui fournit de l'aide de faire une réanimation bouche-à-bouche, lorsque le matériel inhalé est toxique, infectieux ou corrosif.
En cas d'ingestion, ne pas faire vomir. Desserrez les vêtements serrés tels que les cols de chemises, les ceintures ou les cravates. Si la victime ne respire pas, effectuez une réanimation bouche-à-bouche. Dans tous les cas, consultez immédiatement un médecin..
Applications
L'acide chlorique est principalement utilisé pour la formation de sels de chlorate tels que: le chlorate de sodium, de calcium, de magnésium, de strontium, de plomb, de cuivre et d'argent ainsi que le perchlorate de protochlore et de mercure sont préparés en utilisant de l'acide chlorique comme réactif..
Précurseur stable du dioxyde de chlore, il est utilisé dans la production électrochimique de perchlorate d'ammonium de haute pureté (Dotson, 1993).
La principale production d'acide chlorique a commencé pendant la révolution industrielle en Europe et a été utilisée pour fabriquer du chlorure de vinyle pour les tuyaux en PVC..
Une autre utilisation de l'acide est de nombreuses applications à plus petite échelle, y compris le nettoyage domestique, la production de gélatine et d'autres additifs alimentaires, le détartrage et le traitement du cuir (acide chlorique, S.F.).
Les références
- ACIDE CHLORIQUE. (2016). Récupéré de caméochimiques: cameochemicals.noaa.gov.
- acide chlorique. (S.F.). Récupéré de weebly: http://chloricacid.weebly.com/
- ACIDE CHLORIQUE. (S.F.). Récupéré de Chemicalbook: Chemicalbook.com.
- Dotson, R. (1993). Un nouveau procédé électrochimique pour la production de perchlorate d'ammonium. Journal of Applied Electrochemistry Volume 23, Numéro 9,, 897-904. link.springer.com.
- EMBL-EBI. (28 juillet 2014). acide chlorique. Récupéré de ebi.ac.uk: ebi.ac.uk.
- Jacob Green, E. T. (1829). Un manuel de philosophie chimique . Philadelphie: Russell & Martien.
- Centre national d'information sur la biotechnologie… (15 avril 2017). Base de données des composés PubChem; CID = 19654. Récupéré de pubchem: .pubchem.ncbi.nlm.nih.gov.
- Société royale de chimie. (2015). ACIDE CHLORIQUE. Récupéré de chemspider: chemspider.com.

Personne n'a encore commenté ce post.