
Structure de l'acide sulfonique, nomenclature, propriétés, utilisations

Est appelé acide sulfonique tout composé appartenant à une famille d'acides organiques ayant un ou plusieurs groupes -SO3H. Certains auteurs indiquent que le composé d'origine est H-S (= O)deux-OH ou H-SO3H, appelé par certains "acide sulfonique", cependant, son existence n'a pas été prouvée, ni celle de son tautomère HO-S (= O) -OH dit "acide sulfureux" (HdeuxSW3), ni en solution ni à l'état solide.
Ce dernier est dû au fait que le dioxyde de soufre gazeux (IV) (SOdeux) en solution aqueuse est converti en ions bisulfite (HSO3-) et pyrosulfite (SdeuxOU ALORS5deux-) et non H-S (= O)deux-OH ni à HO-S (= O) -OH, ce qui a déjà été vérifié par de nombreux chercheurs en chimie.
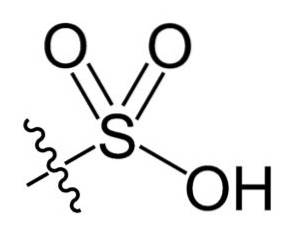
Dans la formule chimique R-SO3H des acides sulfoniques, le groupe R peut représenter des squelettes hydrocarbonés tels que alcane, alcène, alcyne et / ou arène. Ceux-ci peuvent contenir des fonctionnalités secondaires telles que des groupes ester, éther, cétone, amino, amido, hydroxyle, carboxyle et phénol, entre autres..
Les acides sulfoniques sont des acides forts, comparables à l'acide sulfurique (HdeuxSW4). Cependant, le reste de ses propriétés dépend largement de la nature du groupe R..
Certains ont tendance à se désulfoner à des températures élevées. Cela signifie perdre le groupe -SO3H, en particulier lorsque R est un arène, c'est-à-dire avec un cycle benzénique.
Les acides sulfoniques ont de nombreuses utilisations en fonction de leur formule chimique. Ils sont utilisés pour fabriquer des colorants, des encres, des polymères, des détergents, des tensioactifs et comme catalyseurs, parmi de nombreuses autres applications..
Index des articles
- 1 Structure
- 2 Nomenclature
- 3 propriétés
- 4 Obtention
- 4.1 Acides arylsulfoniques
- 4.2 Acides alkylsulfoniques
- 5 utilisations
- 5.1 Acides sulfoniques pour tensioactifs et détergents
- 5.2 Colorants à base d'acides sulfoniques
- 5.3 Amides à base d'acides sulfoniques
- 5.4 Acides sulfoniques fluorés et chlorofluorés
- 5.5 Dans les applications biologiques
- 5.6 Dans l'industrie pétrolière
- 5.7 Dans la formulation de lubrifiants et anticorrosifs
- 6 Références
Structure
Les acides sulfoniques ont la structure générale suivante:
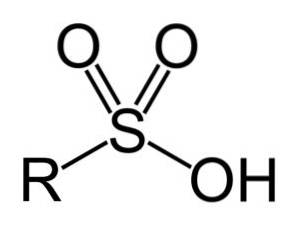
Nomenclature
- Groupe sulfonyle: -SO3H
- Acide alkyle ou arylsulfonique: R-SO3H
Propriétés
Ils sont solides ou liquides selon le groupe R. Les acides sulfoniques gazeux ne sont pas connus.
Leurs propriétés physiques et chimiques dépendent de la nature du groupe R. A titre de comparaison, certaines propriétés physiques de divers acides sulfoniques sont présentées, où p.f. est le point de fusion et par ex. est le point d'ébullition à une pression de 1 mm Hg:
- Acide méthanesulfonique: p.f. 20 ° C; par exemple. 122 ºC
- Acide éthanesulfonique: p.f. -17 ° C; par exemple. 123 ºC
- Acide propanesulfonique: p.f. -37 ° C; par exemple. 159 ºC
- Acide butanesulfonique: p.f. -15 ° C; par exemple. 149 ºC
- Acide pentanesulfonique: p.f. -16 ° C; par exemple. 163 ºC
- Acide hexanesulfonique: p.f. 16 ° C; par exemple. 174 ºC
- Acide benzènesulfonique: p.f. 44 ° C; par exemple. 172 ºC (à 0,1 mm Hg)
- Acide P-toluènesulfonique: p.f. 106 ° C; par exemple. 182 ºC (à 0,1 mm Hg)
- Acide 1-naphtalènesulfonique: p.f. 78 ° C; par exemple. Il se décompose
- Acide 2-naphtalènesulfonique: p.f. 91 ° C; par exemple. Il se décompose
- Acide trifluorométhanesulfonique: p.f. rien; par exemple. 162 ºC (à 760 mm Hg)
La plupart sont très solubles dans l'eau.
Les acides sulfoniques sont encore plus acides que les acides carboxyliques. Ils ont une acidité similaire à celle de l'acide sulfurique. Dissoudre dans de l'hydroxyde de sodium aqueux et du bicarbonate aqueux.
Ils ont tendance à subir une décomposition thermique, provoquant leur désulfonation. Cependant, plusieurs des acides alcanesulfoniques sont thermiquement stables. En particulier, l'acide triflique, ou acide trifluorométhanesulfonique, est l'un des acides les plus forts et les plus stables.
Obtention
Acides arylsulfoniques
Les acides arylsulfoniques sont généralement obtenus par le procédé de sulfonation qui consiste à ajouter un excès d'acide sulfurique fumant (HdeuxSW4 + SW3) au composé organique que l'on souhaite sulfoner. Par exemple dans le cas du benzène:
C6H6 + HdeuxSW4 <-> C6H5SW3H + HdeuxOU ALORS
ArH + HdeuxSW4 <-> ArSO3H + HdeuxOU ALORS
La sulfonation est une réaction réversible, car si nous ajoutons de l'acide dilué à l'acide benzènesulfonique et passons de la vapeur sur le mélange, la réaction d'élimination du SO est générée.3 et le benzène est distillé par volatilisation avec de la vapeur, déplaçant l'équilibre vers la désulfonation.
L'agent sulfonant peut également être de l'acide chlorosulfurique, de l'acide sulfamique ou des ions sulfite..
Acides alkylsulfoniques
Ceux-ci sont généralement préparés par sulfo-oxydation, c'est-à-dire par traitement de composés alkyles avec du dioxyde de soufre SOdeux et oxygène Odeux, ou directement avec du trioxyde de soufre SO3.
RH + 2SOdeux + OU ALORSdeux + HdeuxOU ALORS <--> R-SO3H + HdeuxSW4
Applications
Acides sulfoniques pour tensioactifs et détergents
Les acides alkylbenzènesulfoniques sont utilisés dans la fabrication de détergents, étant l'une des utilisations les plus répandues.
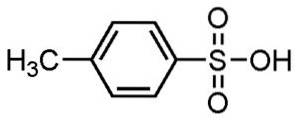
Utilisé pour les détergents en poudre et liquides, les détergents légers ou lourds, les savons pour les mains et les shampooings.
Les composants actifs sont généralement des alkylbenzène sulfonates linéaires et des esters gras sulfonés..
Les tensioactifs courants sont les alpha-oléfinesulfonates, les sulfobétaïnes, les sulfosuccinates et les alkyl diphényléthers disulfonates, tous dérivés d'acides sulfoniques..
Ces tensioactifs trouvent une utilisation dans les produits de nettoyage ménagers, les cosmétiques, la polymérisation en émulsion et la fabrication de produits chimiques agricoles..
Les lignosulfonates sont des dérivés sulfonés de la lignine, un composant du bois, et sont utilisés comme agents dispersants, agents mouillants, liants dans les chaussées routières, adjuvants pour béton et additifs dans l'alimentation animale..
Un dérivé de l'acide 2-naphtalènesulfonique est utilisé pour augmenter la fluidité et la résistance du ciment..
Colorants à base d'acide sulfonique
Celles-ci sont généralement caractérisées en ce qu'elles contiennent des groupes azo (R-N = N-R).
Les colorants dérivés d'acides sulfoniques sont utiles dans l'industrie papetière, les encres telles que l'impression jet d'encre, les textiles tels que le coton et la laine, les cosmétiques, les savons, les détergents, les aliments et le cuir..
Un dérivé de l'acide 2-naphtalènesulfonique est également utilisé comme ingrédient dans les colorants pour fibres de polyester et pour le tannage du cuir..
Amides à base d'acide sulfonique
Les acides acrylamidosulfoniques se distinguent dans cette application, qui sont utilisés dans les polymères, dans l'électrodéposition de métaux, comme tensioactifs et dans les revêtements anti-buée transparents..
Ils sont également utilisés dans la récupération assistée du pétrole, comme agents de démoulage, dans des mélanges de ciment hydraulique et comme accélérateurs de durcissement de la résine aminoplaste..
Certains sulfamides sont également utilisés dans les formules insecticides.
Acides sulfoniques fluorés et chlorofluorés
Dans ce groupe, l'acide trifluorométhanesulfonique (CF3SW3H), également appelé acide triflique. Ce composé a une application dans la synthèse organique et la catalyse des réactions de polymérisation.
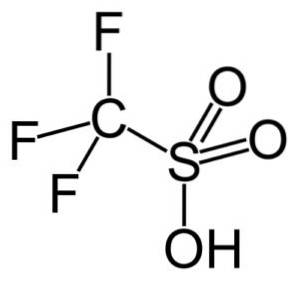
Par exemple, il est utilisé dans la polymérisation d'oléfines aromatiques et dans la préparation d'hydrocarbures paraffiniques hautement ramifiés avec un indice d'octane élevé pour une utilisation comme additifs de carburant..
Une autre de ses applications est dans la synthèse de polymères conducteurs, par dopage de polyacétylène, produisant par exemple des semi-conducteurs de type p.
Acide pentafluoroéthanesulfonique (CF3CFdeuxSW3H), connu sous le nom d'acide pentaphilique, est utilisé comme catalyseur organique.
L'acide triflique réagit avec le pentafluorure d'antimoine (SbF5) générant le soi-disant «acide magique», un catalyseur superacide qui sert à l'alkylation et à la polymérisation.
Nafion-H est une résine échangeuse d'ions d'un acide sulfonique polymère perfluoré. Il a la particularité d'être inerte vis-à-vis des acides forts, des bases fortes et des agents réducteurs ou oxydants..
Dans les applications biologiques
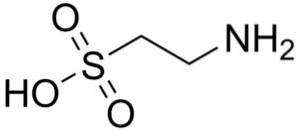
L'un des rares acides sulfoniques trouvés dans la nature est l'acide 2-aminoéthanesulfonique, mieux connu sous le nom de taurine, un acide aminé essentiel en particulier pour les chats..
La taurine synthétique et naturelle est utilisée comme suppléments dans les aliments pour animaux de compagnie et les produits pharmaceutiques..
L'acide taurocholique est un composant de la bile et participe à la digestion des graisses. L'acide 8-anilino-1-naphtalènesulfonique, un composé synthétique, est utilisé dans l'étude des protéines.
Des copolymères d'urée et d'acide biphényldisulfonique ont été utilisés comme inhibiteurs du virus de l'herpès simplex.
Certains dérivés d'acides sulfoniques, tels que le polystyrène sulfoné et certains composés azoïques, ont montré des propriétés inhibitrices du virus de l'immunodéficience humaine ou du VIH, sans être excessivement toxiques vis-à-vis des cellules hôtes..
Dans l'industrie pétrolière
Certains mélanges de dérivés du pétrole, qui comprennent une combinaison variée d'aromatiques, de paraffines et d'aromatiques polynucléaires, peuvent être sulfonés puis correctement neutralisés, générant des soi-disant sulfonates de pétrole..
Ces sulfonates de pétrole ont la propriété d'abaisser la tension superficielle du pétrole dans l'eau. De plus, sa production est à très faible coût.
Pour cette raison, les sulfonates de pétrole sont injectés dans les puits de pétrole existants pour aider à la récupération du pétrole brut emprisonné entre les roches sous la surface..
Dans la formulation de lubrifiants et anticorrosifs
Les sulfonates de magnésium sont largement utilisés dans les formulations de lubrifiants comme additifs détergents-dispersants et pour prévenir l'usure..
Les sulfonates de baryum sont utilisés dans les lubrifiants pour roulements antifriction utilisés dans les applications à haute vitesse. Les sulfonates de sodium et de calcium ont des applications dans les lubrifiants et les graisses pour engrenages pour améliorer les propriétés extrême pression.
Les sels de magnésium d'acides sulfoniques sont également utiles dans les applications anticorrosion telles que les revêtements, les graisses et les résines..
Les références
- Falk, Michael et Giguere, Paul A. (1958). Sur la nature de l'acide sulfureux. Journal canadien de chimie, vol. 36, 1958. Récupéré de nrcresearchpress.com
- Betts, R.H. et Voss, R.H. (1970). La cinétique de l'échange d'oxygène entre l'ion sulfite et l'eau. Revue canadienne de chimie, vol. 48, 1970. Récupéré de nrcresearchpress.com
- Coton, F.A. et Wilkinson, G. (1980). Chimie inorganique avancée. Quatrième édition. Chapitre 16. John Wiley & Sons.
- Kirk-Othmer (1994). Encyclopédie de la technologie chimique. Volume 23. Quatrième édition. John Wiley et fils.
- Kosswig, Kurt. (2012). Tensioactifs. Encyclopédie Ullmann de chimie industrielle, volume 35. Wiley-VCH Verlag GmbH & Co.



Personne n'a encore commenté ce post.