
Structure, propriétés, synthèse du chlorobenzène (C6H5Cl)
le chlorobenzène est un composé aromatique de formule chimique C6H5Cl, spécifiquement un halogénure aromatique. À température ambiante, il s'agit d'un liquide incolore et inflammable, fréquemment utilisé comme solvant et dégraissant. De plus, il sert de matière première pour la fabrication de nombreux composés chimiques très utiles..
Au siècle dernier, il a servi de base à la synthèse de l'insecticide DDT, très utile dans l'éradication de maladies comme le paludisme. Cependant, en 1970, son utilisation a été interdite en raison de sa forte toxicité pour l'homme. La molécule de chlorobenzène est polaire en raison d'une électronégativité plus élevée du chlore par rapport à l'atome de carbone auquel elle se lie.
Il en résulte un chlore ayant une densité modérée de charge négative δ- par rapport au carbone et au reste du cycle aromatique. De même, le chlorobenzène est pratiquement insoluble dans l'eau, mais il est soluble dans les liquides de nature chimique aromatique, tels que: le chloroforme, le benzène, l'acétone, etc..
De plus, Rhodococus phenolicus est une espèce bactérienne capable de dégrader le chlorobenzène comme seule source de carbone..
Index des articles
- 1 Structure chimique
- 2 Propriétés chimiques
- 2.1 Odeur
- 2.2 Poids moléculaire
- 2.3 Point d'ébullition
- 2.4 Point de fusion
- 2.5 Point d'éclair
- 2.6 Solubilité dans l'eau
- 2.7 Solubilité dans les composés organiques
- 2.8 Densité
- 2.9 Densité de vapeur
- 2.10 Pression de vapeur
- 2.11 Auto-inflammation
- 2.12 Viscosité
- 2.13 Corrosivité
- 2.14 Chaleur de combustion
- 2.15 Chaleur de vaporisation
- 2.16 Tension superficielle
- 2.17 Potentiel d'ionisation
- 2.18 Seuil olfactif
- 2.19 Point de congélation expérimental
- 2.20 Stabilité
- 3 Synthèse
- 4 applications
- 4.1 Utilisations en synthèse organique
- 4.2 Utilisations pour la synthèse de solvants organiques
- 4.3 Usages médicinaux
- 5 Références
Structure chimique
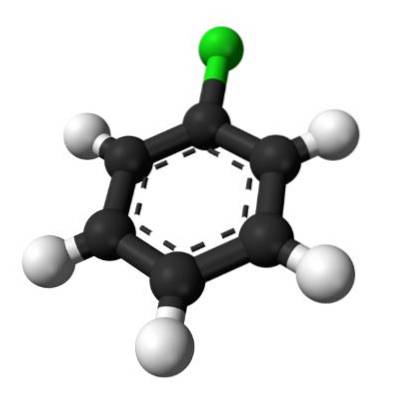
L'image du haut illustre la structure du chlorobenzène. Les sphères noires de carbone constituent le cycle aromatique, tandis que les sphères blanches et les sphères vertes constituent les atomes d'hydrogène et de chlore, en conséquence.
Contrairement à la molécule de benzène, le chlorobenzène a un moment dipolaire. C'est parce que l'atome Cl est plus électronégatif que le reste des carbones hybrides sp.deux.
Pour cette raison, il n'y a pas de distribution uniforme de la densité électronique dans l'anneau, mais la majeure partie est dirigée vers l'atome Cl..
Selon cette explication, avec une carte de densité électronique, il pourrait être corroboré que, bien que faible, il existe une région δ- riche en électrons.
Par conséquent, les molécules de chlorobenzène interagissent les unes avec les autres par le biais de forces dipôle-dipôle. Cependant, ils ne sont pas assez forts pour que ce composé existe en phase solide à température ambiante; pour cette raison, c'est un liquide (mais avec un point d'ébullition plus élevé que le benzène).
Propriétés chimiques
Odeur
Son odeur est douce, pas désagréable et semblable à celle de l'amande.
Poids moléculaire
112,556 g / mol.
Point d'ébullition
131,6 ° C (270 ° F) à une pression de 760 mmHg.
Point de fusion
-45,2 ºC (-49 ºF)
point de rupture
27 ºC (82 ºF)
Solubilité dans l'eau
499 mg / l à 25 ºC.
Solubilité dans les composés organiques
Il est miscible à l'éthanol et à l'éther éthylique. Il est très soluble dans le benzène, le tétrachlorure de carbone, le chloroforme et le disulfure de carbone.
Densité
1,1058 g / cm3 à 20 ° C (1,11 g / cm3 à 68 ° F). C'est un liquide légèrement plus dense que l'eau.
Densité de vapeur
3,88 par rapport à l'air. 3,88 (air = 1).
La pression de vapeur
8,8 mmHg à 68 ° F; 11,8 mmHg à 77 ° F; 120 mmHg à 25 ºC.
Auto-inflammation
593 ºC (1 099 ºC)
Viscosité
0,806 mPoids à 20 ºC.
Corrosivité
Attaque certains types de plastiques, caoutchoucs et certains types de revêtements.
Chaleur de combustion
-3100 kJ / mol à 25 ºC.
Chaleur de vaporisation
40,97 kJ / mol à 25 ºC.
Tension superficielle
33,5 dynes / cm à 20 ° C.
Potentiel d'ionisation
9,07 eV.
Seuil d'odeur
Reconnaissance dans l'air 2.1.10-1 ppm. Faible odeur: 0,98 mg / cm3; odeur élevée: 280 mg / cm3.
Point de congélation expérimental
-45,55 ° C (-50 ° F).
Stabilité
Il est incompatible avec les agents oxydants.
La synthèse
Dans l'industrie, la méthode introduite en 1851 est utilisée, dans laquelle le chlore gazeux (Cldeux) à travers le benzène liquide à une température de 240 ºC en présence de chlorure ferrique (FeCl3), qui agit comme un catalyseur.
C6H6 => C6H5Cl
Le chlorobenzène est également préparé à partir d'aniline dans la réaction de Sandmayer. L'aniline forme du chlorure de benzènediazonium en présence de nitrite de sodium; et le chlorure de benzènediazonium forme du chlorure de benzène en présence de chlorure de cuivre.
Applications
Utilisations en synthèse organique
-Il est utilisé comme solvant, dégraissant et sert de matière première pour l'élaboration de nombreux composés très utiles. Le chlorobenzène a été utilisé dans la synthèse de l'insecticide DDT, actuellement en désuétude en raison de sa toxicité pour l'homme.
-Bien que dans une moindre mesure, le chlorobenzène est utilisé dans la synthèse du phénol, un composé qui a une action fongicide, bactéricide, insecticide, antiseptique et est également utilisé dans la production de produits agrochimiques, ainsi que dans le processus de fabrication de l'acide acétisalicylique..
-Elle intervient dans la fabrication de diisocyanate, un dégraissant pour pièces automobiles.
-Il est utilisé pour obtenir du p-nitrochlorobenzène et du 2,4-dinitrochlorobenzène.
-Il est utilisé dans la synthèse des composés triphénylphosphine, thiophénol et phénylsilane.
-La triphénylphosphine est utilisée dans la synthèse de composés organiques; le thiophénol est un agent pesticide et un intermédiaire pharmaceutique. Au lieu de cela, le phénylsilane est utilisé dans l'industrie du silicone.
-Il fait partie de la matière première pour la fabrication de l'oxyde de diphényle, qui est utilisé comme agent de transfert de chaleur, dans le contrôle des maladies des plantes et dans la fabrication d'autres produits chimiques..
-Le p-nitrochlorobenzène obtenu à partir du chlorobenzène est un composé utilisé comme intermédiaire dans la fabrication de colorants, pigments, produits pharmaceutiques (paracétamol) et dans la chimie du caoutchouc.
Utilisations pour la synthèse de solvants organiques
Le chlorobenzène est également utilisé comme matière première pour la fabrication de solvants utilisés dans les réactions de synthèse de composés organiques, tels que le méthylènediphényldiisocyanate (MDI) et l'uréthane..
MDI est impliqué dans la synthèse du polyuréthane, qui remplit de nombreuses fonctions dans la production de produits de construction, de réfrigérateurs et de congélateurs, de meubles de lit, de chaussures, d'automobiles, de revêtements et d'adhésifs, et d'autres applications.
De même, l'uréthane est une matière première pour la production de composés adjuvants pour l'agriculture, de peintures, d'encres et de solvants de nettoyage destinés à l'électronique..
Utilisations médicales
-Le 2,4-dinitrochlorobenzène a été utilisé en dermatologie dans le traitement de l'alopécie areata. Il a également été utilisé dans les études d'allergie et dans l'immunologie de la dermatite, du vitiligo et dans le pronostic de l'évolution chez les patients atteints de mélanome malin, de verrues génitales et de verrues communes..
-Il a eu une utilisation thérapeutique chez les patients séropositifs. D'autre part, il a été attribué des fonctions immunomodulatrices, un aspect qui est sujet à discussion..
Les références
- Dra. Alessandra B. Alió S. (1998). Dinitrochlorobenzène et ses applications. [PDF]. Dermatologie vénézuélienne, VOL. 36, n ° 1.
- Panoli Intermediates India Private Limited. Para-nitro chloro benzène (PNCB). Récupéré le 4 juin 2018 de: panoliindia.com
- Korry Barnes. (2018). Chlorobenzène: propriétés, réactivité et utilisations. Extrait le 4 juin 2018 de: study.com
- Wikipédia. (2018). Chlorobenzène. Récupéré le 4 juin 2018 sur: en.wikipedia.org
- PubChem. (2018). Chlorobenzène. Extrait le 4 juin 2018 de: pubchem.ncbi.nlm.nih.gov



Personne n'a encore commenté ce post.