
Propriétés, structure, utilisations du chlorure de plomb
le chlorure de plomb est un sel inorganique dont la formule chimique est PbCln, où n est le nombre d'oxydation du plomb. Donc, quand le plomb est +2 ou +4, le sel est PbCldeux ou PbCl4, respectivement. Par conséquent, il existe deux types de chlorures pour ce métal.
Des deux, le PbCldeux c'est le plus important et le plus stable; tandis que PbCl4 il est instable et moins utile. Le premier est de nature ionique, où le cation Pbdeux+ génère des interactions électrostatiques avec l'anion Cl- pour construire un réseau cristallin; et le second est covalent, avec des liaisons Pb-Cl à l'origine d'un tétraèdre de plomb et de chlore.

Une autre différence entre les deux chlorures de plomb est que le PbCldeux C'est un solide de cristaux blancs en forme d'aiguilles (image du haut); tandis que PbCl4 C'est une huile jaunâtre qui peut cristalliser à -15 ° C. Entrée PbCldeux c'est plus esthétique que PbCl4.
En plus de ce qui a déjà été mentionné, le PbCldeux on le trouve dans la nature sous forme de cotunite minérale; tandis que le PbCl4 non, car il est susceptible de se décomposer. Bien que de PbCl4 vous pouvez obtenir le PbOdeux, de PbCldeux dérivent une variété infinie de composés organométalliques.
Index des articles
- 1 Propriétés
- 1.1 -Chlorure de plomb (II)
- 1.2 Chlorure de plomb (IV)
- 2 Structure
- 2.1 -Chlorure de plomb (II)
- 2.2 Molécule en phase gazeuse
- 3 Nomenclature
- 4 utilisations
- 5 Références
Propriétés
Les propriétés du chlorure de plomb dépendent essentiellement de l'indice d'oxydation du plomb; puisque le chlore ne change pas, mais la façon dont il interagit avec le plomb le fait. Par conséquent, les deux composés doivent être traités séparément; le chlorure de plomb (II) d'une part, et le chlorure de plomb (IV) d'autre part.
-Chlorure de plomb (II)
Masse molaire
278,10 g / mol.
Apparence physique
Cristaux de couleur blanche avec des formes d'aiguilles.
Densité
5,85 g / mL.
Point de fusion
501 ° C.
Point d'ébullition
950 ° C.
Solubilité dans l'eau
10,8 g / L à 20 ° C Il est peu soluble et l'eau doit être chauffée pour qu'une quantité considérable puisse se dissoudre.
Indice de réfraction
2 199.
Chlorure de plomb (IV)
Masse molaire
349,012 g / mol.
Apparence physique
Liquide huileux jaunâtre.
Densité
3,2 g / mL.
Point de fusion
-15 ° C.
Point d'ébullition
50 ° C À des températures plus élevées, il se décompose en libérant du chlore gazeux:
PbCl4(s) => PbCldeux(s) + Cldeux(g)
En fait, cette réaction peut devenir très explosive, le PbCl est donc stocké.4 en acide sulfurique à -80 ° C.
Structure
-Chlorure de plomb (II)
Au début, il a été mentionné que PbCldeux est un composé ionique, donc il se compose d'ions Pbdeux+ et Cl- qui construisent un cristal dans lequel un rapport Pb: Cl égal à 1: 2 est établi; c'est-à-dire qu'il y a deux fois plus d'anions Cl- quels cations Pbdeux+.
Le résultat est que se forment des cristaux orthorhombiques dont les ions peuvent être représentés avec un modèle de sphères et de barres comme dans l'image ci-dessous..

Cette structure correspond également à celle du minéral cotunite. Bien que les barres soient utilisées pour indiquer une directionnalité de la liaison ionique, il ne faut pas la confondre avec une liaison covalente (ou du moins, purement covalente).
Dans ces cristaux orthorhombiques, le Pbdeux+ (sphères grisâtres) a neuf Cl- (sphères vertes) l'entourant, comme s'il était enfermé dans un prisme triangulaire. En raison de la complexité de la structure et de la faible densité ionique du Pbdeux+, il est difficile pour les molécules de solvater le cristal; raison pour laquelle il est peu soluble dans l'eau froide.
Molécule de phase gazeuse
Lorsque ni le cristal ni le liquide ne peuvent résister aux températures élevées, les ions commencent à se vaporiser sous forme de molécules de PbCl.deux discret; c'est-à-dire avec des liaisons covalentes Cl-Pb-Cl et un angle de 98 °, comme s'il s'agissait d'un boomerang. On dit alors que la phase gazeuse est constituée de ces molécules de PbCldeux et pas d'ions transportés par les courants d'air.
Chlorure de plomb (IV)
Pendant ce temps, le PbCl4 c'est un composé covalent. Parce que? Parce que le cation Pb4+ il est plus petit et a également une densité de charge ionique plus élevée que Pbdeux+, ce qui provoque une plus grande polarisation du nuage d'électrons Cl-. Le résultat est qu'au lieu d'une interaction de type ionique Pb4+Cl-, la liaison covalente Pb-Cl est formée.
Compte tenu de cela, la similitude entre PbCl4 et, par exemple, le CCl4; les deux se présentent sous la forme de molécules tétraédriques uniques. Ainsi, on explique pourquoi ce chlorure de plomb est une huile jaunâtre dans des conditions normales; Les atomes de Cl sont mal liés entre eux et «glissent» lorsque deux molécules de PbCl4 ils viendront.
Cependant, lorsque la température baisse et que les molécules ralentissent, la probabilité et les effets des dipôles instantanés (PbCl4 est apolaire compte tenu de sa symétrie); puis l'huile gèle sous forme de cristaux hexagonaux jaunes:
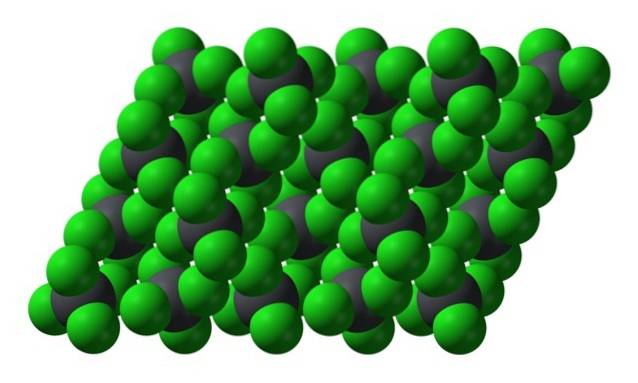
Notez que chaque sphère grisâtre est entourée de quatre sphères vertes. Ces molécules de PbCl4 "Pressé ensemble" constitue un cristal instable qui est susceptible de se décomposer vigoureusement.
Nomenclature
Les dénominations: chlorure de plomb (II) et chlorure de plomb (IV) correspondent à celles attribuées selon la nomenclature Stock. Étant donné que l'indice d'oxydation +2 est le plus bas pour le plomb et +4 le plus élevé, les deux chlorures peuvent être nommés selon la nomenclature traditionnelle en tant que chlorure de plumbose (PbCldeux) et le chlorure de plomb (PbCl4), respectivement.
Et enfin, il y a la nomenclature systématique, qui met en évidence le nombre de chaque atome du composé. Ainsi, le PbCldeux est le dichlorure de plomb et le PbCl4 tétrachlorure de plomb.
Applications
Il n'y a pas d'utilisation pratique connue du PbCl4 en plus de servir à la synthèse de PbOdeux. Cependant, le PbCldeux C'est plus utile et c'est pourquoi seules certaines utilisations de ce chlorure de plomb spécifique seront énumérées ci-dessous:
- En raison de sa nature hautement luminescente, il est destiné aux détecteurs photographiques, acoustiques, optiques et de rayonnement.
- Comme il n'absorbe pas dans la région du spectre infrarouge, il est utilisé pour la fabrication de verres qui transmettent ce type de rayonnement.
- Il fait partie de ce qu'on appelle le verre doré, un matériau attrayant aux colorations bleuâtres irisées utilisées à des fins ornementales..
- Aussi, poursuivant sur le sujet de l'art, une fois alcalinisé, le PbCldeuxPb (OH)deux Il acquiert des tons blanchâtres intenses, étant utilisé comme pigment de plomb blanc. Cependant, son utilisation a été déconseillée en raison de sa forte toxicité..
- Fondu et mélangé avec du titanate de baryum, BaTiO3, est à l'origine du titanate de baryum plomb céramique Ba1 - xPbXL'oncle3. Si un Pbdeux+ entrer dans le BaTiO3, un Badeux+ il doit quitter le cristal pour permettre son incorporation, et on dit alors qu'un échange de cations se produit; d'où la composition du Badeux+ est exprimé par 1-x.
- Et enfin, du PbCldeux plusieurs composés organométalliques du plomb de formule générale R sont synthétisés4Pb ou R3Pb-PbR3.
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). Chlorure de plomb (II). Récupéré de: en.wikipedia.org
- Formulation chimique. (2019). Chlorure de plomb (IV). Récupéré de: formulacionquimica.com
- Clark Jim. (2015). Les chlorures de carbone, de silicium et de plomb. Récupéré de: chemguide.co.uk
- Etudes non linéaires spectrales et optiques sur le chlorure de plomb (PbCldeux) cristaux. [PDF]. Récupéré de: shodhganga.inflibnet.ac.in
- Centre national d'information sur la biotechnologie. (2019). Chlorure de plomb. Base de données PubChem; CID = 24459. Récupéré de: pubchem.ncbi.nlm.nih.gov

Personne n'a encore commenté ce post.