
Expression de concentration chimique, unités, molalité

La concentration chimique est la mesure numérique de la quantité relative de soluté dans une solution. Cette mesure exprime un rapport du soluté à une quantité ou un volume de solvant ou de solution en unités de concentration. Le terme «concentration» est lié à la quantité de soluté présent: une solution sera plus concentrée plus elle contient de soluté.
Ces unités peuvent être physiques lorsque les grandeurs massiques et / ou volumiques de la solution ou des composants chimiques sont prises en compte, lorsque la concentration du soluté est exprimée en termes de moles ou d'équivalents, en prenant le nombre d'Avogadro comme référence..

Ainsi, en utilisant des poids moléculaires ou atomiques et le nombre d'Avogadro, il est possible de convertir des unités physiques en unités chimiques lors de l'expression de la concentration d'un soluté donné. Par conséquent, toutes les unités peuvent être converties pour la même solution.
Index des articles
- 1 Solutions diluées et concentrées
- 2 façons d'exprimer la concentration
- 2.1 Description qualitative
- 2.2 Classification par solubilité
- 2.3 Notation quantitative
- 3 unités de concentration
- 3.1 Unités de concentration relatives
- 3.2 Unités de concentration diluée
- 3.3 Unités de concentration en fonction des moles
- 3.4 Formalité et normalité
- 4 Molarité
- 4.1 Exercice 1
- 4.2 Exercice 2
- 5 Normalité
- 5.1 Calcul
- 5.2 Exercice 1
- 6 Molalité
- 6.1 Exercice 1
- 7 Notes et recommandations importantes sur la concentration chimique
- 7.1 Le volume de la solution est toujours supérieur à celui du solvant
- 7.2 Utilité de la molarité
- 7.3 Les formules ne sont pas mémorisées mais les unités ou définitions
- 8 Références
Solutions diluées et concentrées
Comment savoir si une concentration est très diluée ou concentrée? À première vue par la manifestation de l'une de ses propriétés organoleptiques ou chimiques; c'est-à-dire ceux que les sens perçoivent ou qui peuvent être mesurés.
L'image ci-dessus montre une dilution d'une concentration de bichromate de potassium (KdeuxCrdeuxOU ALORS7), qui présente une couleur orange. De gauche à droite, vous pouvez voir comment la couleur diminue son intensité à mesure que la concentration est diluée, ajoutant plus de solvant.
Cette dilution permet d'obtenir de cette manière une concentration diluée à partir d'une concentration concentrée. La couleur (et d'autres propriétés «cachées» dans son noyau orange) change de la même manière que sa concentration, soit avec des unités physiques ou chimiques..
Mais quelles sont les unités chimiques de concentration? Parmi eux se trouvent la molarité ou concentration molaire d'une solution, qui rapporte les moles de soluté par le volume total de la solution en litres.
Il y a aussi la molalité ou aussi appelée concentration molaire, qui fait référence aux moles de soluté mais qui sont contenues dans une quantité normalisée du solvant ou du solvant qui est exactement d'un kilogramme.
Ce solvant peut être pur ou si la solution contient plus d'un solvant, la molalité sera les moles de soluté par kilogramme du mélange de solvants..
Et la troisième unité de concentration chimique est la normalité ou la concentration normale d'une solution qui exprime le nombre d'équivalents chimiques du soluté par litre de solution.
L'unité dans laquelle la normalité est exprimée est en équivalents par litre (Eq / L) et en médecine la concentration d'électrolytes dans le sérum humain est exprimée en milliéquivalents par litre (mEq / L).
Façons d'exprimer la concentration

La concentration d'une solution peut être désignée de trois manières principales, même si elles ont une grande variété de termes et d'unités eux-mêmes, qui peuvent être utilisées pour exprimer la mesure de cette valeur: description qualitative, notation quantitative et classification en termes de solubilité.
En fonction de la langue et du contexte dans lesquels vous travaillez, l'une des trois manières sera choisie pour exprimer la concentration d'un mélange.
Description qualitative
Utilisée principalement dans un langage informel et non technique, la description qualitative de la concentration d'un mélange est exprimée sous forme d'adjectifs, qui indiquent de manière généralisée le niveau de concentration d'une solution.
De cette manière, le niveau de concentration minimum selon la description qualitative est celui d'une solution «diluée», et le maximum est celui de «concentré»..
On parle de solutions diluées lorsqu'une solution a une très faible proportion de soluté en fonction du volume total de la solution. Si vous souhaitez diluer une solution, vous devez ajouter plus de solvant ou trouver un moyen de réduire le soluté.
Or, on parle de solutions concentrées lorsqu'elles ont une forte proportion de soluté en fonction du volume total de solution. Pour concentrer une solution, vous devez ajouter plus de soluté ou réduire la quantité de solvant.
En ce sens, cette classification s'appelle une description qualitative, non seulement parce qu'elle manque de mesures mathématiques mais aussi en raison de sa qualité empirique (elle peut être attribuée à des caractéristiques visuelles, des odeurs et des goûts, sans qu'il soit nécessaire de recourir à des tests scientifiques)..
Classification par solubilité
La solubilité d'une concentration désigne la capacité maximale de soluté d'une solution, en fonction de conditions telles que la température, la pression et les substances dissoutes ou en suspension..
Les solutions peuvent être classées en trois types en fonction de leur niveau de soluté dissous au moment de la mesure: solutions insaturées, saturées et sursaturées.
- Les solutions insaturées sont celles qui contiennent moins de soluté que la solution ne peut en dissoudre. Dans ce cas, la solution n'a pas atteint sa concentration maximale.
- Les solutions saturées sont celles dans lesquelles la quantité maximale de soluté possible s'est dissoute dans le solvant à une température spécifique. Dans ce cas, il y a un équilibre entre les deux substances et la solution ne peut pas accepter plus de soluté (car il précipitera).
- Les solutions sursaturées contiennent plus de soluté que la solution n'accepterait dans des conditions d'équilibre. Ceci est accompli en chauffant une solution saturée, en ajoutant plus de soluté que la normale. Une fois froid, il ne précipitera pas automatiquement le soluté, mais toute perturbation peut provoquer cet effet en raison de son instabilité..
Notation quantitative
Lors de l'étude d'une solution à utiliser dans le domaine technique ou scientifique, une précision mesurée et exprimée en unités est requise, qui décrivent la concentration en fonction de ses valeurs exactes de masse et / ou de volume..
C'est pourquoi il existe une série d'unités utilisées pour exprimer la concentration d'une solution dans sa notation quantitative, qui sont divisées en physique et chimique, et qui à leur tour ont leurs propres subdivisions.
Les unités de concentrations physiques sont celles de «concentration relative», qui sont exprimées en pourcentages. Il existe trois façons d'exprimer les concentrations en pourcentage: les pourcentages massiques, les pourcentages volumiques et les pourcentages masse-volume..
Au lieu de cela, les unités de concentrations chimiques sont basées sur des quantités molaires, des équivalents-grammes, des parties par million et d'autres caractéristiques du soluté par rapport à la solution..
Ces unités sont les plus courantes en raison de leur haute précision lors de la mesure des concentrations, et pour cette raison, ce sont généralement celles que vous souhaitez connaître pour travailler avec des solutions chimiques..
Unités de concentration
Comme décrit dans les sections précédentes, lors de la caractérisation quantitative de la concentration d'une solution, les calculs doivent être régis par les unités existantes à cet effet..
De même, les unités de concentration sont divisées en celles de concentration relative, celles de concentrations diluées, celles basées sur les moles et d'autres supplémentaires..
Unités de concentration relative
Les concentrations relatives sont celles exprimées en pourcentages, comme indiqué dans la section précédente. Ces unités sont divisées en pourcentage masse-masse, pourcentage volume-volume et pourcentage masse-volume, et sont calculées comme suit:
- % masse = masse de soluté (g) / masse de solution totale (g) x 100
- % volume = volume de soluté (ml) / volume de solution totale (ml) x 100
- % masse / volume = masse de soluté (g) / volume de solution totale (ml) x 100
Dans ce cas, pour calculer la masse ou le volume de la solution totale, il faut ajouter la masse ou le volume du soluté à celui du solvant..
Unités de concentration diluée
Les unités de concentration diluées sont celles utilisées pour exprimer ces très petites concentrations qui se retrouvent sous forme de traces au sein d'une solution diluée; l'utilisation la plus courante de ces unités est de trouver des traces d'un gaz dissous dans un autre, comme des agents polluant l'air.
Ces unités sont indiquées sous forme de parties par million (ppm), parties par milliard (ppb) et parties par billion (ppt), et sont exprimées comme suit:
- ppm = 1 mg de soluté / 1 L de solution
- ppb = 1 μg de soluté / 1 L de solution
- ppt = 1 ng de soluté / 1 L de solution
Dans ces expressions, mg équivaut à des milligrammes (0,001 g), μg équivaut à des microgrammes (0,000001 g) et ng équivaut à des nanogrammes (0,000000001 g). Ces unités peuvent également être exprimées en fonction du volume / volume.
Unités de concentration en fonction des moles
Les unités de concentration basées sur les moles sont celles de la fraction molaire, du pourcentage molaire, de la molarité et de la molalité (ces deux dernières sont mieux décrites en fin d'article).
La fraction molaire d'une substance est la fraction de toutes ses molécules constitutives (ou atomes) en fonction du total des molécules ou atomes. Il est calculé comme suit:
XÀ = nombre de moles de substance A / nombre total de moles en solution
Cette procédure est répétée pour les autres substances en solution, en tenant compte du fait que la somme de XÀ + XB + XC ... doit être égal à un.
Le pourcentage molaire est travaillé de la même manière que XÀ, uniquement en pourcentage:
Pourcentage molaire de A = XÀ x 100%
La dernière section abordera en détail la molarité et la molalité..
Formalité et normalité
Enfin, deux unités de concentration sont actuellement en désuétude: la formalité et la normalité..
La formalité d'une solution représente le nombre de poids-formule-gramme par litre de solution totale. Il s’exprime comme suit:
F = n ° P.F.G / L solution
Dans cette expression P.F.G est égal au poids de chaque atome de la substance, exprimé en grammes.
Au lieu de cela, la normalité représente le nombre d'équivalents de soluté divisé par des litres de solution, comme indiqué ci-dessous:
N = grammes équivalents de soluté / L de solution
Dans cette expression, les grammes équivalents de soluté peuvent être calculés par le nombre de moles H+, Oh- ou d'autres méthodes, selon le type de molécule.
Molarité
La molarité ou concentration molaire d'un soluté est l'unité de concentration chimique qui exprime ou relie les moles du soluté (n) contenues dans un (1) litre (L) de la solution.
La molarité est désignée par la lettre majuscule M et pour déterminer les moles du soluté (n), les grammes du soluté (g) sont divisés par le poids moléculaire (MW) du soluté..
De même, le poids moléculaire MW du soluté est obtenu à partir de la somme des poids atomiques (PA) ou de la masse atomique des éléments chimiques, compte tenu de la proportion dans laquelle ils se combinent pour former le soluté. Ainsi, différents solutés ont leur propre PM (bien que ce ne soit pas toujours le cas).
Ces définitions sont résumées dans les formules suivantes qui sont utilisées pour effectuer les calculs correspondants:
Molarité: M = n (moles de soluté) / V (litre de solution)
Nombre de moles: n = g de soluté / MW de soluté
Exercice 1
Calculer la molarité d'une solution préparée avec 45 g de Ca (OH)deux dissous dans 250 ml d'eau.
La première chose à calculer est le poids moléculaire de Ca (OH)deux (hydroxyde de calcium). Selon sa formule chimique, le composé est composé d'un cation calcium et de deux anions hydroxyle. Ici, le poids d'un électron inférieur ou supplémentaire à l'espèce est négligeable, donc les poids atomiques sont pris:
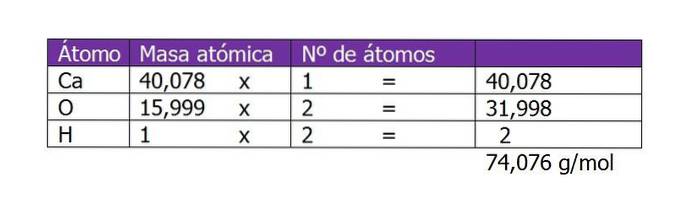
Le nombre de moles du soluté sera alors:
n = 45 g / (74 g / mol)
n = 0,61 mole de Ca (OH)deux
On obtient 0,61 mole du soluté mais il est important de se rappeler que ces moles sont dissoutes dans 250 mL de solution. Puisque la définition de la molarité est moles dans un litre ou 1000 mL, une règle simple de trois doit alors être faite pour calculer les moles qui sont dans 1000 mL de ladite solution
Si dans 250 mL de solution il y a => 0,61 mole de soluté
Dans 1000 mL de solution => x Combien de moles y a-t-il?
x = (0,61 mol) (1000 ml) / 250 ml
X = 2,44 M (mol / L)
Autrement
L'autre façon d'obtenir les grains de beauté pour appliquer la formule nécessite que les 250 ml soient pris en litres, en appliquant également une règle de trois:
Si 1000 ml => sont 1 litre
250 ml => x Combien de litres sont?
x = (250 ml) (1 L) / 1000 ml
x = 0,25 L
En remplaçant alors dans la formule de molarité:
M = (0,61 mol de soluté) / (0,25 L de solution)
M = 2,44 mol / L
Exercice 2
Qu'est-ce que cela signifie pour une solution de HCl à 2,5 M?
La solution de HCl est de 2,5 molaires, c'est-à-dire qu'un litre de celui-ci a dissous 2,5 moles d'acide chlorhydrique..
Normal
La normalité ou concentration équivalente est l'unité de concentration chimique des solutions désignée par la lettre majuscule N. Cette unité de concentration indique la réactivité du soluté et est égale au nombre d'équivalents de soluté (Eq) entre le volume de la solution exprimé en litres.
N = Eq / L
Le nombre d'équivalents (Eq) est égal aux grammes de soluté divisé par le poids équivalent (PEq).
Eq = g soluté / PEq
Le poids équivalent, ou également appelé équivalent gramme, est calculé en obtenant le poids moléculaire du soluté et en le divisant par un facteur équivalent qui, aux fins de résumer dans l'équation, est appelé delta zeta (ΔZ).
PEq = PM / ΔZ
Calcul
Le calcul de la normalité aura une variation très spécifique du facteur équivalent ou ΔZ, qui dépend également du type de réaction chimique à laquelle participe le soluté ou l'espèce réactive. Quelques cas de cette variation peuvent être mentionnés ci-dessous:
-Lorsqu'il s'agit d'un acide ou d'une base, ΔZ ou le facteur équivalent, sera égal au nombre d'ions hydrogène (H+) ou hydroxyle OH- qui a le soluté. Par exemple, l'acide sulfurique (HdeuxSW4) a deux équivalents car il a deux protons acides.
-En ce qui concerne les réactions d'oxydoréduction, ΔZ correspondra au nombre d'électrons impliqués dans le processus d'oxydation ou de réduction, selon le cas particulier. C'est là que l'équilibre des équations chimiques et la spécification de la réaction entrent en jeu..
-De même, ce facteur équivalent ou ΔZ correspondra au nombre d'ions qui précipitent dans des réactions classées comme précipitation..
Exercice 1
Déterminer la normalité de 185 g de NadeuxSW4 trouvé dans 1,3 L de solution.
Le poids moléculaire du soluté dans cette solution sera d'abord calculé:
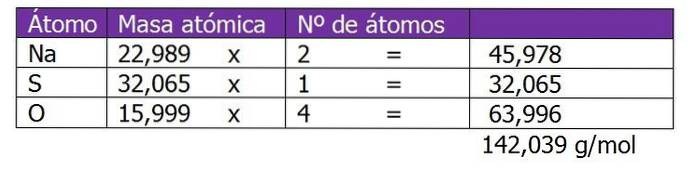
La deuxième étape consiste à calculer le facteur équivalent ou ΔZ. Dans ce cas, le sulfate de sodium étant un sel, la valence ou la charge du cation ou du métal Na sera considérée.+, qui sera multiplié par 2, qui est l'indice de la formule chimique du sel ou du soluté:
N / AdeuxSW4 => ∆Z = Cation Valence x Indice
∆Z = 1 x 2
Pour obtenir le poids équivalent, il est substitué dans son équation respective:
PEq = (142,039 g / mol) / (2 Eq / mol)
PEq = 71,02 g / éq
Et puis vous pouvez procéder au calcul du nombre d'équivalents, en recourant à nouveau à un autre calcul simple:
Éq = (185 g) / (71,02 g / Éq)
Nombre d'équivalents = 2.605 Eq
Enfin, avec toutes les données nécessaires, la normalité est maintenant calculée en substituant selon sa définition:
N = 2,605 équ. / 1,3 L
N = 2,0 N
Molalité
La molalité est désignée par la lettre minuscule m y est égal aux moles de soluté présentes dans un (1) kilogramme de solvant. Elle est également connue sous le nom de concentration molaire et est calculée à l'aide de la formule suivante:
m = moles de soluté / Kg de solvant
Alors que la molarité établit le rapport des moles de soluté contenues dans un (1) litre de la solution, la molalité concerne les moles de soluté qui existent dans un (1) kilogramme de solvant.
Dans les cas où la solution est préparée avec plus d'un solvant, la molalité exprimera les mêmes moles de soluté par kilogramme du mélange de solvants..
Exercice 1
Déterminer la molalité d'une solution préparée en mélangeant 150 g de saccharose (C12H220Onze) avec 300 g d'eau.
Le poids moléculaire du saccharose est d'abord déterminé pour procéder au calcul des moles de soluté dans cette solution:
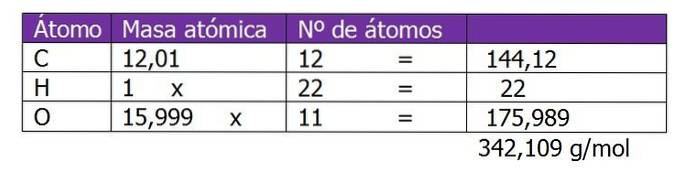
Le nombre de moles de saccharose est calculé:
n = (150 g de saccharose) / (342,109 g / mol)
n = 0,438 mole de saccharose
Ensuite, les grammes de solvant sont portés en kilogrammes pour pouvoir appliquer la formule finale.
En remplaçant alors:
m = 0,438 mole de saccharose / 0,3 kilogramme d'eau
m = 1,46 mol C12H220Onze/ Kg HdeuxOU ALORS
Bien qu'il y ait actuellement un débat sur l'expression finale de la molalité, ce résultat peut également être exprimé comme suit:
1,26 m C12H220Onze ou 1,26 molal
Il est parfois jugé avantageux d'exprimer la concentration de la solution en termes de molalité, car les masses du soluté et du solvant ne subissent pas de légères fluctuations ou de changements inapparents dus aux effets de la température ou de la pression; comme cela se produit dans les solutions avec un soluté gazeux.
De plus, il est précisé que cette unité de concentration rapportée à un soluté spécifique est inchangée par l'existence d'autres solutés dans la solution..
Recommandations et notes importantes sur la concentration chimique
Le volume de la solution est toujours supérieur à celui du solvant
Au fur et à mesure que les exercices de résolution sont résolus, l'erreur se pose d'interpréter le volume d'une solution comme s'il s'agissait de celui du solvant. Par exemple, si un gramme de chocolat en poudre est dissous dans un litre d'eau, le volume de la solution n'est pas égal à celui d'un litre d'eau..
Pourquoi pas? Parce que le soluté occupera toujours un espace entre les molécules de solvant. Lorsque le solvant a une forte affinité pour le soluté, le changement de volume après dissolution peut être négligeable ou négligeable..
Mais, sinon, et encore plus si la quantité de soluté est importante, le changement de volume doit être pris en compte. De cette façon: Vsolvent + Vsolute = Vsolution. Uniquement dans des solutions diluées ou lorsque les quantités de soluté sont faibles est valide Vsolvant = Vsolution.
Cette erreur doit être gardée à l'esprit, en particulier lorsque vous travaillez avec des solutés liquides. Par exemple, si au lieu de dissoudre du chocolat en poudre, le miel est dissous dans de l'alcool, alors le volume de miel ajouté aura des effets significatifs sur le volume total de la solution..
Par conséquent, dans ces cas, le volume du soluté doit être ajouté à celui du solvant..
Utilité de la molarité
-Connaître la molarité d'une solution concentrée permet d'effectuer des calculs de dilution en utilisant la formule simple M1V1 = M2V2, où M1 correspond à la molarité initiale de la solution et M2 la molarité de la solution à préparer à partir de la solution M1.
-Connaissant la molarité d'une solution, sa normalité peut être facilement calculée en utilisant la formule suivante: Normalité = nombre d'équivalents x M
Les formules ne sont pas mémorisées mais les unités ou définitions sont
Cependant, la mémoire ne parvient parfois pas à se souvenir de toutes les équations pertinentes pour les calculs de concentration. Pour cela, il est très utile d'avoir une définition très claire de chaque concept.
À partir de la définition, les unités sont écrites à l'aide du facteurs de conversion pour exprimer ceux qui correspondent à ce que vous voulez déterminer.
Par exemple, si vous avez une molalité et que vous souhaitez la convertir en normale, procédez comme suit:
(mol / Kg solvant) x (kg / 1000g) (g solvant / mL) (mL solvant / mL solution) (1000 mL / L) (Eq / mol)
Notez que (g solvant / mL) est la densité du solvant. Le terme (mL de solvant / mL de solution) fait référence à la quantité de volume de la solution correspondant réellement au solvant. Dans de nombreux exercices, ce dernier terme est égal à 1, pour des raisons pratiques, bien qu'il ne soit jamais totalement vrai..
Les références
- Chimie d'introduction - 1st Édition canadienne. Unités quantitatives de concentration. Chapitre 11 Solutions. Tiré de: opentextbc.ca
- Wikipédia. (2018). Concentration équivalente. Tiré de: en.wikipedia.org
- PharmaFactz. (2018). Qu'est-ce que la molarité? Tiré de: pharmafactz.com
- Whitten, Davis, Peck et Stanley. Chimie. (8e éd.). Apprentissage CENGAGE, p 101-103, 512, 513.
- Solutions aqueuses-Molarité. Tiré de: chem.ucla.edu
- Quimicas.net (2018). Exemples de normalité. Récupéré de: quimicas.net.

Personne n'a encore commenté ce post.