
Construction de la configuration électronique du noyau, exemples
La configuration électronique du noyau ou compact est celui dont les notations quantiques pour le nombre d'électrons et leurs sous-niveaux d'énergie sont abrégées par les symboles de gaz rares entre parenthèses. Il est très utile lors de l'écriture de configurations électroniques pour un certain élément, car il est simple et rapide.
Le mot «noyau» fait généralement référence aux enveloppes électroniques internes d'un atome; c'est-à-dire ceux dans lesquels leurs électrons ne sont pas de valence et ne participent donc pas à la liaison chimique, bien qu'ils définissent les propriétés de l'élément. Métaphoriquement parlant, le noyau serait l'intérieur de l'oignon, avec ses couches composées d'une série d'orbitales augmentant en énergie.
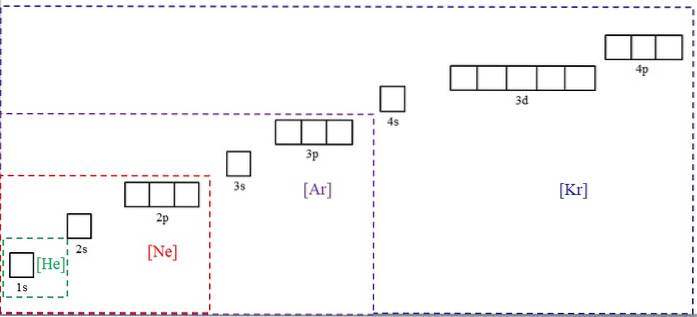
L'image ci-dessus montre les symboles chimiques de quatre des gaz rares entre parenthèses et avec des couleurs différentes: [He] (vert), [Ne] (rouge), [Ar] (violet) et [Kr] (bleu).
Chacun de ses cadres en pointillés contient des cases qui représentent les orbitales. Plus ils sont gros, plus le nombre d'électrons qu'ils contiennent est grand; ce qui à son tour signifiera que les configurations électroniques de plusieurs éléments peuvent être simplifiées avec ces symboles. Cela économise du temps et de l'énergie en écrivant toutes les notations.
Index des articles
- 1 Ordre de construction
- 2 Abréviation de la configuration électronique
- 3 exemples
- 3.1 Général
- 3.2 Oxygène
- 3.3 Potassium
- 3.4 Indien
- 3.5 Tungstène
- 4 Références
Ordre de construction
Avant d'utiliser les configurations électroniques du noyau, il est judicieux de vérifier le bon ordre pour construire ou écrire ces configurations. Ceci est régi selon la règle des diagonales ou diagramme de Moeller (appelé dans certaines parties la méthode de la pluie). Ayant ce diagramme à portée de main, les notations quantiques sont les suivantes:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Cette chaîne de notations quantiques semble épuisante; et il le serait encore plus s'il devait être écrit à chaque fois que la configuration électronique de tout élément trouvé à partir de la période 5 allait être représentée. Notez également que la corde est vide d'électrons; il n'y a pas de nombres dans les angles droits supérieurs (1sdeux2 sdeux2 P6…).
Il faut se rappeler que les orbitales s peut «héberger» deux électrons (nsdeux). Orbitales p il y en a trois au total (regardez les trois cases ci-dessus), elles peuvent donc accueillir six électrons (np6). Et enfin, les orbitales ré il y en a cinq, et le F sept, avec un total de dix (nddix) et quatorze (nf14) électrons, respectivement.
Abréviation de la configuration électronique
Cela dit, nous procédons à remplir la rangée précédente de notations quantiques avec des électrons:
1sdeux 2 sdeux 2 P6 3 sdeux 3p6 4 sdeux 3ddix 4p6 5 sdeux 4jdix 5 p6 6 sdeux 4f14 5 jdix 6p6 7 sdeux 5f14 6jdix 7p6
Combien y a-t-il d'électrons en tout? 118. Et à quel élément correspond un si grand nombre d'électrons dans son atome? À l'oganeson des gaz rares, Og.
Supposons qu'il y ait un élément avec un nombre quantique Z égal à 119. Alors sa configuration électronique de valence serait 8s1; mais quelle serait sa configuration électronique complète?
1sdeux 2 sdeux 2 P6 3 sdeux 3p6 4 sdeux 3ddix 4p6 5 sdeux 4jdix 5 p6 6 sdeux 4f14 5 jdix 6p6 7 sdeux 5f14 6jdix 7p6 8 s1
Et quelle serait votre configuration de noyau électronique, la configuration compacte? Est:
[Og] 8s1
Notez la simplification ou l'abréviation évidente. Dans le symbole [Og] tous les 118 électrons écrits ci-dessus sont comptés, donc cet élément incertain a 119 électrons, dont un seul est de valence (il serait situé sous le francium dans le tableau périodique).
Exemples
général
Supposons maintenant que vous souhaitiez faire progressivement l'abréviation:
[He] 2sdeux 2 P6 3 sdeux 3p6 4 sdeux 3ddix 4p6 5 sdeux 4jdix 5 p6 6 sdeux 4f14 5 jdix 6p6 7 sdeux 5f14 6jdix 7p6
Notez que 1sdeux il a été remplacé par [He]. Le prochain gaz rare est le néon, qui a 10 électrons. Sachant cela, l'abréviation continue:
[Ne] 3sdeux 3p6 4 sdeux 3ddix 4p6 5 sdeux 4jdix 5 p6 6 sdeux 4f14 5 jdix 6p6 7 sdeux 5f14 6jdix 7p6
Puis l'argon suit, avec 18 électrons:
[Ar] 4sdeux 3ddix 4p6 5 sdeux 4jdix 5 p6 6 sdeux 4f14 5 jdix 6p6 7 sdeux 5f14 6jdix 7p6
Comme le prochain gaz rare est le krypton, l'abréviation est avancée de 36 électrons supplémentaires:
[Kr] 5sdeux 4jdix 5 p6 6 sdeux 4f14 5 jdix 6p6 7 sdeux 5f14 6jdix 7p6
Le xénon a 54 électrons, et par conséquent, nous déplaçons l'abréviation sur l'orbitale 5p:
[Xe] 6sdeux 4f14 5 jdix 6p6 7 sdeux 5f14 6jdix 7p6
A présent, vous aurez remarqué que la configuration électronique est toujours abrégée en orbitale np; c'est-à-dire que les gaz rares ont ces orbitales remplies d'électrons. Et enfin le radon suit, avec 86 électrons, nous abrégons donc à l'orbitale 6p:
[Rn] 7sdeux 5f14 6jdix 7p6
Oxygène
L'oxygène possède huit électrons, sa configuration électronique complète étant:
1sdeux2 sdeux2 P4
La seule abréviation que nous pouvons utiliser est [He] pour 1sdeux. Ainsi, votre configuration de noyau électronique devient:
[He] 2sdeux2 P4
Potassium
Le potassium possède dix-neuf électrons, sa configuration électronique complète étant:
1sdeux 2 sdeux 2 P6 3 sdeux 3p6 4 s1
Notez que nous pouvons utiliser le symbole [He] pour abréger cette configuration; ainsi que [Ne] et [Ar]. Ce dernier est celui utilisé car l'argon est le gaz rare qui se rapproche le plus du potassium. Donc, la configuration de votre noyau d'électrons ressemble à:
[Ar] 4s1
Indien
L'indium possède quarante-neuf électrons, sa configuration électronique complète étant:
1sdeux 2 sdeux 2 P6 3 sdeux 3p6 4 sdeux 3ddix 4p6 5 sdeux 4jdix 5 p1
Puisque le krypton est le gaz rare le plus proche qui précède l'indium, le symbole [Kr] est utilisé pour l'abréviation, et nous avons sa configuration électronique de noyau:
[Kr] 5sdeux 4jdix 5 p1
Bien que les orbitales 4d n'appartiennent pas formellement au noyau d'indium, leurs électrons ne sont pas impliqués (du moins dans des conditions normales) dans sa liaison métallique, mais plutôt ceux des orbitales 5s et 5p..
Tungstène
Le tungstène (ou wolfram) a 74 électrons et sa configuration électronique complète est:
1sdeux 2 sdeux 2 P6 3 sdeux 3p6 4 sdeux 3ddix 4p6 5 sdeux 4jdix 5 p6 6 sdeux 4f14 5 j4
Encore une fois, nous recherchons le gaz rare le plus proche qui le précède. Dans votre cas, cela correspond au xénon, qui a ses orbitales 5p complètes. Nous remplaçons donc la chaîne de notations quantiques par le symbole [Xe], et nous aurons enfin sa configuration électronique du noyau:
[Xe] 6sdeux 4f14 5 j4
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Pat Thayer. (2016). Diagrammes de configuration d'électrons. Récupéré de: chemistryapp.org
- Helmenstine, Anne Marie, Ph.D. (5 décembre 2018). Définition du noyau de gaz noble. Récupéré de: thinkingco.com/
- Wikipédia. (2019). Configuration électronique. Récupéré de: es.wikipedia.org


Personne n'a encore commenté ce post.