
Coprécipitation en quoi consiste-t-elle, types et applications

La coprécipitation C'est la contamination d'une substance insoluble qui transporte les solutés dissous du milieu liquide. Ici, le mot «contamination» est appliqué pour les cas où des solutés solubles précipités par un support insoluble ne sont pas souhaitables; mais lorsqu'ils ne le sont pas, une autre méthode analytique ou synthétique est en cours.
Par contre, le support insoluble est la substance précipitée. Celui-ci peut transporter le soluté soluble à l'intérieur (absorption) ou à sa surface (adsorption). La façon dont vous le faites changera complètement les propriétés physicochimiques du solide résultant..
Bien que le concept de coprécipitation puisse sembler un peu déroutant, il est plus courant que vous ne le pensez. Parce que? Car, plus que de simples solides contaminés, des solutions solides de structures complexes et riches en composants inestimables se forment. Le sol à partir duquel les plantes se nourrissent sont des exemples de coprécipitation.
De même, les minéraux, les céramiques, les argiles et les impuretés dans la glace sont également le produit de ce phénomène. Sinon, les sols perdraient une grande partie de leurs éléments essentiels, les minéraux ne seraient pas tels qu'ils sont actuellement connus, et il n'y aurait pas de méthode importante pour la synthèse de nouveaux matériaux..
Index des articles
- 1 Qu'est-ce que la coprécipitation?
- 2 types
- 2.1 Inclusion
- 2.2 Occlusion
- 2.3 Adsorption
- 3 applications
- 4 Références
Qu'est-ce que la coprécipitation?
Pour mieux comprendre l'idée de coprécipitation, l'exemple suivant est proposé.
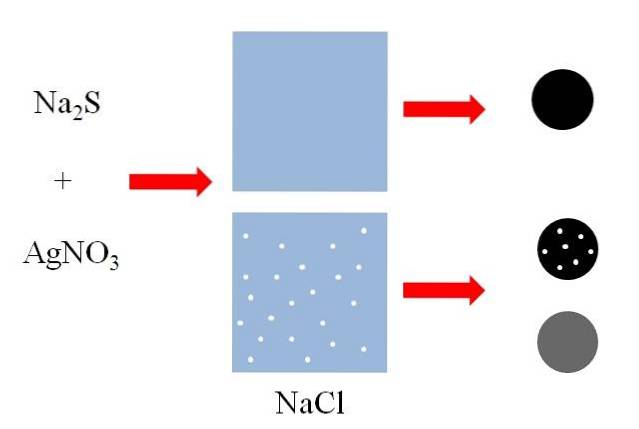
Au-dessus (image du haut), il y a deux récipients contenant de l'eau, dont l'un contient du NaCl dissous. Le NaCl est un sel hautement soluble dans l'eau, mais la taille des points blancs est exagérée à des fins explicatives. Chaque point blanc deviendra de petits agrégats de NaCl dans une solution au bord de la saturation.
Un mélange de sulfure de sodium, NadeuxS et nitrate d'argent, AgNO3, précipitera un solide noir insoluble de sulfure d'argent, AgS:
N / AdeuxS + AgNO3 => AgS + NaNO3
Comme on peut le voir dans le premier récipient d'eau, un solide noir (sphère noire) précipite. Cependant, ce solide dans le récipient contenant du NaCl dissous transporte des particules de ce sel (sphère noire avec des points blancs). Le NaCl est soluble dans l'eau, mais lorsque l'AgS précipite, il est adsorbé sur la surface noire.
On dit alors que le NaCl a coprécipité sur l'AgS. Si le solide noir était analysé, des micro-cristaux de NaCl pourraient être vus à la surface.
Cependant, ces cristaux pourraient également se trouver à l'intérieur de l'AgS, de sorte que le solide «deviendrait» grisâtre (blanc + noir = gris).
Les types
La sphère noire avec des points blancs et la sphère grise montrent qu'un soluté soluble peut coprécipiter de différentes manières..
Dans le premier, il le fait superficiellement, adsorbé sur le support insoluble (AgS dans l'exemple précédent); tandis que dans le second, il le fait en interne, "changeant" la couleur noire du précipité.
Pouvez-vous obtenir d'autres types de solides? Autrement dit, une sphère avec des phases noires et blanches, c'est-à-dire d'AgS et de NaCl (avec NaNO3 qui coprécipite également). C'est ici que naît l'ingéniosité de la synthèse de nouveaux solides et matériaux.
Cependant, pour revenir au point de départ, fondamentalement, le soluté soluble coprécipite générant différents types de solides. Les types de coprécipitation et les solides qui en résultent seront mentionnés ci-dessous..
Inclusion
On parle d'inclusion lorsque dans le réseau cristallin, l'un des ions peut être remplacé par l'une des substances solubles co-précipitées.
Par exemple, si NaCl avait coprécipité par inclusion, les ions Na+ aurait remplacé Ag+ dans une section de l'arrangement cristallin.
Cependant, de tous les types de coprécipitation, c'est le moins probable; car, pour que cela se produise, les rayons ioniques doivent être très similaires. En revenant à la sphère grise de l'image, l'inclusion en viendrait à être représentée par l'un des tons grisâtres plus clairs.
Comme je viens de le mentionner, l'inclusion se produit dans des solides cristallins, et pour les obtenir, il faut maîtriser la chimie des solutions et plusieurs facteurs (T, pH, temps d'agitation, rapports molaires, etc.).
Occlusion
En occlusion, les ions sont piégés dans le réseau cristallin mais sans remplacer aucun ion dans le réseau. Par exemple, des cristaux de NaCl occlus peuvent se former dans l'AgS. Graphiquement, il pourrait être visualisé comme un cristal blanc entouré de cristaux noirs.
Ce type de coprécipitation est l'un des plus courants, et grâce à lui, il y a la synthèse de nouveaux solides cristallins. Les particules occluses ne peuvent pas être éliminées par un simple lavage. Pour ce faire, il faudrait recristalliser l'ensemble de l'assemblage, c'est-à-dire le support insoluble.
L'inclusion et l'occlusion sont des processus d'absorption donnés dans les structures cristallines.
Adsorption
Lors de l'adsorption, le solide coprécipité repose à la surface du support insoluble. La taille des particules de ce support définit le type de solide obtenu.
S'ils sont petits, un solide coagulé sera obtenu, à partir duquel il est facile d'éliminer les impuretés; mais s'ils sont très petits, le solide absorbera de grandes quantités d'eau et sera gélatineux.
Revenant à la sphère noire avec des points blancs, les cristaux de NaCl coprécipités sur l'AgS peuvent être lavés à l'eau distillée. Ainsi de suite jusqu'à ce que l'AgS soit purifié, qui peut ensuite être chauffé pour évaporer toute l'eau.
Applications
Quelles sont les applications de la coprécipitation? Certains d'entre eux sont les suivants:
-Il permet de quantifier les substances solubles qui ne sont pas facilement précipitées dans le milieu. Ainsi, à travers un support insoluble, il transporte, par exemple, des isotopes radioactifs, tels que le francium, pour complément d'étude et d'analyse..
-En coprécipitant des ions dans des solides gélatineux, vous purifiez le milieu liquide. L'occlusion est encore plus souhaitable dans ces cas, car l'impureté ne pourra pas s'échapper vers l'extérieur.
-La coprécipitation permet d'incorporer des substances dans des solides lors de leur formation. Si le solide est un polymère, il absorbera des solutés solubles qui co-précipiteront à l'intérieur, lui conférant de nouvelles propriétés. S'il s'agit de cellulose, par exemple, du cobalt (ou un autre métal) pourrait y être coprécipité.
-En plus de tout ce qui précède, la coprécipitation est l'une des méthodes clés pour la synthèse de nanoparticules sur un support insoluble. Grâce à cela, des bionanomatériaux et des nanoparticules de magnétite ont été synthétisés, entre autres..
Les références
- Day, R. et Underwood, A. (1986). Chimie analytique quantitative (cinquième éd.). Salle des Prentices PEARSON.
- Wikipédia. (2018). Coprécipitation. Récupéré de: en.wikipedia.org
- NPTEL. (s.f.). Précipitations et coprécipitations. Récupéré de: nptel.ac.in
- Wise Geek. (2018). Qu'est-ce que la coprécipitation. Récupéré de: wisegeek.com
- Wilson Sacchi Peternele, Victoria Monge Fuentes, Maria Luiza Fascineli et al. (2014). Enquête expérimentale sur la méthode de coprécipitation: une approche pour obtenir des nanoparticules de magnétite et de maghémite avec des propriétés améliorées. Journal of Nanomaterials, vol. 2014, numéro d'article 682985, 10 pages.


Personne n'a encore commenté ce post.