
Propriétés, caractéristiques et utilisations du chrome

le chrome (Cr) est un élément métallique du groupe 6 (VIB) du tableau périodique. Des tonnes de ce métal sont produites chaque année grâce à son extraction du fer chromite minéral ou du magnésium (FeCrdeuxOU ALORS4, MgCrdeuxOU ALORS4), qui sont réduits avec du carbone pour obtenir le métal. Il est très réactif, et ce n'est que dans des conditions très réductrices qu'il se trouve sous sa forme pure.
Son nom dérive du mot grec «chroma», qui signifie couleur. On lui a donné ce nom en raison des couleurs multiples et intenses que présentent les composés du chrome, qu'ils soient inorganiques ou organiques; des solides ou solutions noirs au jaune, orange, vert, violet, bleu et rouge.

Cependant, la couleur du chrome métallique et de ses carbures est grisâtre argenté. Cette caractéristique est exploitée dans la technique du chromage pour donner à de nombreuses structures des paillettes argentées (comme celles que l'on voit chez le crocodile sur l'image ci-dessus). Ainsi, en "baignant avec du chrome", les pièces reçoivent un éclat et une grande résistance à la corrosion..
Le chrome en solution réagit rapidement avec l'oxygène de l'air pour former des oxydes. En fonction du pH et des conditions d'oxydation du milieu, il peut acquérir différents nombres d'oxydation, étant (III) (Cr3+) le plus stable de tous. Par conséquent, l'oxyde de chrome (III) (CrdeuxOU ALORS3) de couleur verte est le plus stable de ses oxydes.
Ces oxydes peuvent interagir avec d'autres métaux de l'environnement, provoquant par exemple le pigment plomb rouge de Sibérie (PbCrO4). Ce pigment est jaune-orange ou rouge (selon son alcalinité), et à partir de lui le scientifique français Louis Nicolas Vauquelin a isolé le cuivre métallique, c'est pourquoi il est récompensé comme son découvreur.
Ses minéraux et oxydes, ainsi qu'une infime partie de cuivre métallique font de cet élément le numéro 22 des plus abondants de la croûte terrestre..
La chimie du chrome est très diversifiée car elle peut former des liaisons avec presque tout le tableau périodique. Chacun de ses composés présente des couleurs qui dépendent du nombre d'oxydation, ainsi que des espèces qui interagissent avec lui. De même, il forme des liaisons avec le carbone, intervenant dans un grand nombre de composés organométalliques..
[TOC]
Caractéristiques et propriétés
Le chrome est un métal argenté sous sa forme pure, avec un numéro atomique de 24 et un poids moléculaire d'environ 52 g / mol (52Cr, son isotope le plus stable).
Compte tenu de ses fortes liaisons métalliques, il présente des points de fusion élevés (1907 ºC) et des points d'ébullition (2671 ºC). De plus, sa structure cristalline en fait un métal très dense (7,19 g / mL).
Il ne réagit pas avec l'eau pour former des hydroxydes, mais il réagit avec les acides. Il s'oxyde avec l'oxygène de l'air, produisant généralement de l'oxyde chromique, qui est un pigment vert largement utilisé..
Ces couches d'oxyde créent ce que l'on appelle passivation, protéger le métal de la corrosion ultérieure, car l'oxygène ne peut pas pénétrer dans le sinus métallique.
Sa configuration électronique est [Ar] 4s13d5, avec tous les électrons non appariés, et présente donc des propriétés paramagnétiques. Cependant, l'appariement de spins électroniques peut se produire si le métal est soumis à de basses températures, acquérant d'autres propriétés telles que l'antiferromagnétisme.
Index des articles
- 1 Caractéristiques et propriétés
- 2 Structure chimique du chrome
- 3 nombre d'oxydation
- 3,1 Cr (-2, -1 et 0)
- 3.2 Cr (I) et Cr (II)
- 3,3 Cr (III)
- 3,4 Cr (IV) et Cr (V)
- 3,5 Cr (VI): le couple chromate-dichromate
- 4 utilisations du chrome
- 4.1 Comme colorant ou pigments
- 4.2 Dans le chromage ou la métallurgie
- 4.3 Nutritionnelle
- 5 Où est?
- 6 Références
Structure chimique du chrome
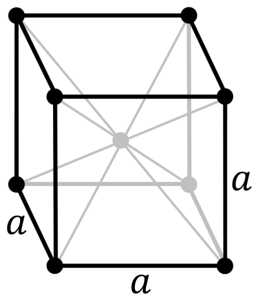
Quelle est la structure du métal chromé? Dans sa forme pure, le chrome prend une structure cristalline cubique centrée sur le corps (cc ou bcc). Cela signifie que l'atome de chrome est situé au centre d'un cube, dont les bords sont occupés par d'autres chromes (comme dans l'image ci-dessus).
Cette structure est responsable du chrome ayant des points de fusion et d'ébullition élevés, ainsi qu'une grande dureté. Les atomes de cuivre chevauchent leurs orbitales s et d pour former des bandes de conduction selon la théorie des bandes.
Ainsi, les deux bandes sont à moitié pleines. Parce que? Parce que sa configuration électronique est [Ar] 4s13d5 et comme l'orbitale s peut loger deux électrons, et les orbitales d dix. Ensuite, seule la moitié des bandes formées par leurs chevauchements sont occupées par des électrons..
Avec ces deux perspectives - la structure cristalline et la liaison métallique - de nombreuses propriétés physiques de ce métal peuvent être expliquées en théorie. Cependant, ni l'un ni l'autre n'explique pourquoi le chrome peut avoir différents états ou nombres d'oxydation..
Cela nécessiterait une compréhension approfondie de la stabilité de l'atome par rapport aux spins électroniques..
Numéro d'oxydation
Parce que la configuration électronique du chrome est [Ar] 4s13d5 peut gagner jusqu'à un ou deux électrons (Cr1- et CRdeux-), ou les perdre pour acquérir différents nombres d'oxydation.
Ainsi, si le chrome perd un électron, il resterait comme [Ar] 4s03d5; s'il en perd trois, [Ar] 4s03d3; et s'il les perd tous, [Ar], ou ce qui est égal, ce serait isoélectronique à l'argon.
Le chrome ne perd ni ne gagne des électrons par simple caprice: il doit y avoir une espèce qui les donne ou les accepte pour passer d'un nombre d'oxydation à un autre.
Le chrome a les numéros d'oxydation suivants: -2, -1, 0, +1, +2, +3, +4, +5 et +6. Parmi eux +3, Cr3+, c'est le plus stable et donc le plus prédominant de tous; suivi de +6, Cr6+.
Cr (-2, -1 et 0)
Le chrome est très peu susceptible de gagner des électrons, car il s'agit d'un métal et, par conséquent, sa nature est de les donner. Cependant, il peut se coordonner avec des ligands, c'est-à-dire des molécules qui interagissent avec le centre métallique via une liaison dative..
L'un des plus connus est le monoxyde de carbone (CO), qui forme le composé hexacarbonyle du chrome.
Ce composé a la formule moléculaire Cr (CO)6, et comme les ligands sont neutres et ne fournissent aucune charge, alors Cr a un indice d'oxydation de 0.
Ceci peut également être observé dans d'autres composés organométalliques tels que le bis (benzène) chrome. Dans ce dernier, le chrome est entouré de deux anneaux benzéniques dans une structure moléculaire de type sandwich:
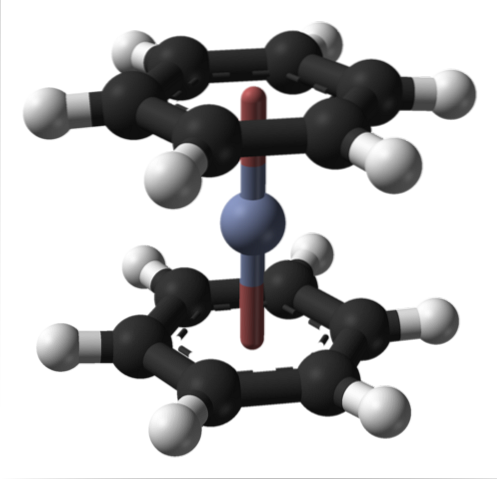
De ces deux composés organométalliques, de nombreux autres peuvent provenir du Cr (0).
Des sels ont été trouvés là où ils interagissent avec les cations sodium, ce qui implique que Cr doit avoir un indice d'oxydation négatif pour attirer les charges positives: Cr (-2), Nadeux[Cr (CO)5] et Cr (-1), Nadeux[Crdeux(CO)dix].
Cr (I) et Cr (II)
Cr (I) ou Cr1+ Il est produit par l'oxydation des composés organométalliques qui viennent d'être décrits. Ceci est réalisé en oxydant des ligands, tels que CN ou NO, formant ainsi, par exemple, le composé K3[Cr (CN)5NE PAS].
Ici le fait d'avoir trois cations K+ Cela implique que le complexe de chrome a trois charges négatives; aussi le ligand CN- contribue cinq charges négatives, de sorte qu'entre Cr et NO doit ajouter deux charges positives (-5 + 2 = -3).
Si le NON est neutre, alors c'est Cr (II), mais s'il a une charge positive (NON+), est dans ce cas Cr (I).
En revanche, les composés Cr (II) sont plus abondants, dont les suivants: chlorure de chrome (II) (CrCldeux), acétate chromé (Crdeux(OU ALORSdeuxCCH3)4), oxyde de chrome (II) (CrO), sulfure de chrome (II) (CrS), etc..
Cr (III)
De tous, c'est celui qui a la plus grande stabilité, car il est en fait le produit de nombreuses réactions oxydatives d'ions chromate. Peut-être que sa stabilité est due à sa configuration électronique d3, dans laquelle trois électrons occupent trois orbitales d d'énergie inférieure par rapport aux deux autres plus énergétiques (division des orbitales d).
Le composé le plus représentatif de cet indice d'oxydation est l'oxyde de chrome (III) (CrdeuxOU ALORS3). Selon les ligands qui s'y coordonnent, le complexe présentera une couleur ou une autre. Des exemples de ces composés sont: [CrCldeux(HdeuxOU ALORS)4] Cl, Cr (OH)3, CrF3, [Cr (HdeuxOU ALORS)6]3+, etc.
Bien que la formule chimique ne le montre pas à première vue, le chrome a généralement une sphère de coordination octaédrique dans ses complexes; c'est-à-dire qu'il est situé au centre d'un octaèdre où ses sommets sont positionnés par les ligands (six au total).
Cr (IV) et Cr (V)
Les composés auxquels le Cr participe5+ sont très peu nombreux, du fait de l'instabilité électronique dudit atome, en plus d'être facilement oxydés en Cr6+, beaucoup plus stable car isoélectronique par rapport à l'argon gaz rare.
Cependant, les composés Cr (V) peuvent être synthétisés dans certaines conditions, telles que la haute pression. De même, ils ont tendance à se décomposer à des températures modérées, ce qui rend leurs applications possibles impossibles car ils n'ont pas de résistance thermique. Certains d'entre eux sont: CrF5 et K3[Cr (Odeux)4] (le Odeuxdeux- est l'anion peroxyde).
D'autre part, le Cr4+ il est relativement plus stable, étant capable de synthétiser ses composés halogénés: CrF4, CrCl4 et CrBr4. Cependant, ils sont également susceptibles d'être décomposés par des réactions redox pour produire des atomes de chrome avec de meilleurs indices d'oxydation (tels que +3 ou +6)..
Cr (VI): le couple chromate-dichromate
2 [CrO4]deux- + 2H+ (Jaune) => [CrdeuxOU ALORS7]deux- + HdeuxO (orange)
L'équation ci-dessus correspond à la dimérisation acide de deux ions chromate pour produire du dichromate. La variation du pH entraîne une modification des interactions autour du centre métallique du Cr6+, également évident dans la couleur de la solution (du jaune à l'orange ou vice versa). Le bichromate se compose d'un pont en O3Cr-O-CrO3.
Les composés du Cr (VI) ont les caractéristiques d'être nocifs et même cancérigènes pour le corps humain et les animaux.
Comment? Des études soutiennent que les ions CrO4deux- traverser les membranes cellulaires par l'action de protéines de transport de sulfate (les deux ions sont en fait de taille similaire).
Les agents réducteurs dans les cellules réduisent le Cr (VI) en Cr (III), qui s'accumule en se coordonnant de manière irréversible à des sites spécifiques sur les macromolécules (comme l'ADN).
Contaminé la cellule par un excès de chrome, elle ne peut pas sortir en raison de l'absence de mécanisme qui la ramène à travers les membranes.
Utilisations du chrome
Comme colorant ou pigments
Le chrome a une large gamme d'applications, du colorant pour différents types de tissus, au protecteur qui embellit les pièces métalliques dans ce que l'on appelle le chromage, qui peut être fabriqué avec du métal pur, ou avec des composés Cr (III) ou Cr (VI).
Fluorure chromique (CrF3), par exemple, est utilisé comme colorant pour les tissus de laine; sulfate chromique (Crdeux(SW4)3), il est utilisé pour colorer les émaux, les céramiques, les peintures, les encres, les vernis, et il est également utilisé pour le chrome des métaux; et oxyde chromique (CrdeuxOU ALORS3) trouve également son utilité là où sa jolie couleur verte est requise.
Par conséquent, tout minéral de chrome aux couleurs intenses peut être destiné à tacher une structure, mais après cela, le fait se pose de savoir si ces composés sont dangereux ou non pour l'environnement ou pour la santé des individus..
En fait, ses propriétés toxiques sont utilisées pour préserver le bois et d'autres surfaces des attaques d'insectes..
En chrome ou en métallurgie
De petites quantités de chrome sont également ajoutées à l'acier pour le renforcer contre l'oxydation et pour améliorer sa brillance. En effet, il est capable de former des carbures grisâtres (Cr3Cdeux) très résistant à la réaction avec l'oxygène de l'air.
Parce que le chrome peut être poli pour obtenir des surfaces brillantes, le chrome présente alors des motifs et des couleurs argentés comme une alternative moins chère à ces fins..
Nutritionnel
Certains se demandent si le chrome peut être considéré comme un élément essentiel, c'est-à-dire indispensable dans l'alimentation quotidienne. Il est présent dans certains aliments en très petites concentrations, comme les feuilles vertes et les tomates..
De même, il existe des suppléments protéiques qui régulent l'activité de l'insuline et favorisent la croissance musculaire, comme c'est le cas avec le polynicotinate de chrome.
Où est-il situé?

Le chrome se trouve dans une grande variété de minéraux et de pierres précieuses tels que les rubis et les émeraudes. Le principal minéral à partir duquel le chrome est extrait est la chromite (MCrdeuxOU ALORS4), où M peut être tout autre métal auquel est associé l'oxyde de chrome. Ces mines abondent en Afrique du Sud, en Inde, en Turquie, en Finlande, au Brésil et dans d'autres pays.
Chaque source a une ou plusieurs variantes de chromite. De cette manière, pour chaque M (Fe, Mg, Mn, Zn, etc.), un minéral de chrome différent apparaît.
Pour extraire le métal, il est nécessaire de réduire le minéral, c'est-à-dire de faire gagner des électrons au centre du métal chromé par l'action d'un réducteur. Cela se fait avec du carbone ou de l'aluminium:
FeCrdeuxOU ALORS4 + 4C => Fe + 2Cr + 4CO
Aussi, la chromite (PbCrO4).
Généralement, dans tout minéral où l'ion Cr3+ peut remplacer Al3+, tous deux avec des rayons ioniques légèrement similaires, constituent une impureté qui se traduit par une autre source naturelle de ce métal étonnant, mais nocif.
Les références
- Tenenbaum E. Chrome. Tiré de: chemistry.pomona.edu
- Wikipédia. (2018). Chrome. Tiré de: en.wikipedia.org
- Anne Marie Helmenstine, Ph.D. (6 avril 2018). Quelle est la différence entre Chrome et Chrome? Tiré de: thinkco.com
- N.V. Mandich. (Année mille neuf cents quatre-vingts-quinze). Chimie du chrome. [PDF]. Tiré de: citeseerx.ist.psu.edu
- Chimie LibreTexts. Chimie du chrome. Tiré de: chem.libretexts.org
- Saul 1. Shupack. (1991). La chimie du chrome et certains problèmes analytiques qui en résultent. Révisé de: ncbi.nlm.nih.gov
- Advameg, Inc. (2018). Chrome. Tiré de: chemistryexplained.com



Personne n'a encore commenté ce post.