
Diagramme de Moeller de ce qu'il consiste et exercices résolus
le Diagramme de Moeller o La méthode Rain est une méthode graphique et mnémotechnique pour apprendre la règle de Madelung; c'est-à-dire comment écrire la configuration électronique d'un élément. Il est caractérisé en dessinant des diagonales à travers les colonnes des orbitales et en suivant la direction de la flèche, l'ordre approprié de la même chose pour un atome est établi.
Dans certaines parties du monde, le diagramme de Moeller est également connu sous le nom de méthode de la pluie. Grâce à cela, un ordre est défini dans le remplissage des orbitales, qui sont également définies par les trois nombres quantiques n, l Oui ml.
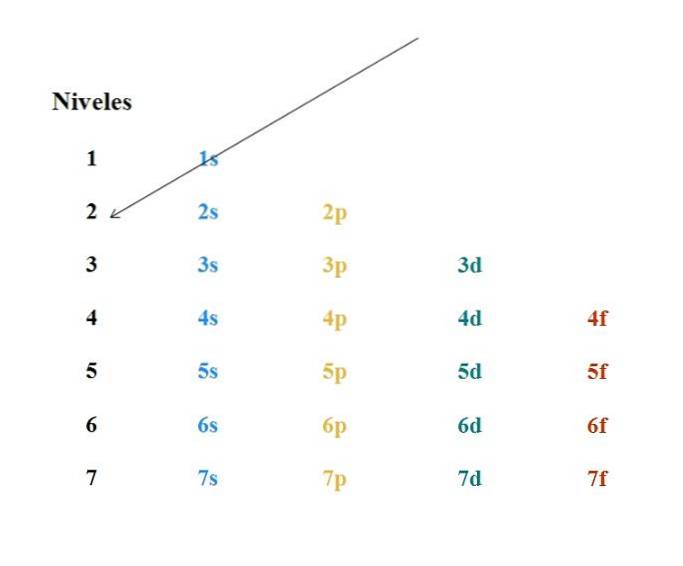
Un simple diagramme de Moeller est présenté dans l'image ci-dessus. Chaque colonne correspond à différentes orbitales: s, p, d et f, avec leurs niveaux d'énergie respectifs. La première flèche indique que le remplissage de tout atome doit commencer par l'orbitale 1s.
Ainsi, la flèche suivante doit partir de l'orbitale 2s, puis de l'orbitale 2p par l'orbite 3s. De cette façon, comme s'il s'agissait d'une pluie, les orbitales et le nombre d'électrons qu'elles contiennent (4l+deux).
Le diagramme de Moeller représente une introduction pour ceux qui étudient les configurations électroniques..
Index des articles
- 1 Qu'est-ce que le diagramme de Moeller?
- 1.1 Règle de Madelung
- 1.2 Étapes à suivre
- 2 exercices résolus
- 2.1 Béryllium
- 2.2 Phosphore
- 2.3 Zirconium
- 2.4 Iridium
- 2.5 Exceptions au diagramme de Moeller et à la règle de Madelung
- 3 Références
Qu'est-ce que le diagramme de Moeller?
Règle de Madelung
Puisque le diagramme de Moeller consiste en une représentation graphique de la règle de Madelung, il est nécessaire de savoir comment cette dernière fonctionne. Le remplissage des orbitales doit obéir aux deux règles suivantes:
-Les orbitales avec les valeurs les plus faibles de n+l sont remplis en premier, étant n le nombre quantique principal, et l le moment cinétique orbital. Par exemple, l'orbite 3d correspond à n= 3 et l= 2, donc, n+l= 3 + 2 = 5; pendant ce temps, l'orbitale 4s correspond à n= 4 et l= 0 et n+l= 4 + 0 = 4. D'après ce qui précède, il est établi que les électrons remplissent l'orbitale 4s en premier que la 3d.
-Si deux orbitales ont la même valeur de n+l, les électrons occuperont en premier celui avec la valeur la plus faible de n. Par exemple, l'orbitale 3d a une valeur de n+l= 5, comme l'orbitale 4p (4 + 1 = 5); mais puisque 3d a la plus petite valeur de n, se remplira avant 4 heures.
D'après les deux observations précédentes, l'ordre suivant de remplissage des orbitales peut être atteint: 1s 2s 2p 3s 3p 4s 3d 4p.
Suivre les mêmes étapes pour différentes valeurs de n+l pour chaque orbitale, les configurations électroniques des autres atomes sont obtenues; qui à son tour peut également être déterminé par le diagramme de Moeller graphiquement.
Pas à suivre
La règle de Madelung énonce la formule n+l, avec laquelle la configuration électronique peut être "armée". Cependant, comme mentionné, le diagramme de Moeller le représente déjà graphiquement; il suffit donc de suivre ses colonnes et de dessiner les diagonales étape par étape.
Comment alors démarrer la configuration électronique d'un atome? Pour ce faire, il faut d'abord connaître son numéro atomique Z, qui par définition pour un atome neutre est égal au nombre d'électrons.
Ainsi, avec Z, le nombre d'électrons est obtenu, et dans cet esprit, nous commençons à dessiner des diagonales à travers le diagramme de Moeller.
Les orbitales s peuvent accueillir deux électrons (en appliquant la formule 4l+2), les p six électrons, le d dix et le f quatorze. Il s'arrête à l'orbitale où le dernier électron donné par Z a été occupé.
Pour plus de précisions, vous trouverez ci-dessous une série d'exercices résolus.
Exercices résolus
Béryllium
En utilisant le tableau périodique, l'élément béryllium est localisé avec un Z = 4; c'est-à-dire que ses quatre électrons doivent être logés dans les orbitales.
En commençant ensuite par la première flèche du diagramme de Moeller, l'orbitale 1s occupe deux électrons: 1sdeux; suivi de l'orbitale 2s, avec deux électrons supplémentaires pour ajouter jusqu'à 4 au total: 2sdeux.
Par conséquent, la configuration électronique du béryllium, exprimée en [Be], est de 1sdeux2 sdeux. Notez que la somme des exposants est égale au nombre d'électrons totaux.
Correspondre
L'élément phosphore a un Z = 15, et donc, il a 15 électrons au total qui doivent occuper les orbitales. Pour avancer, vous commencez tout de suite avec le réglage 1sdeux2 sdeux, qui contient 4 électrons. Ensuite, 9 électrons de plus seraient manquants.
Après l'orbitale 2s, la flèche suivante "entre" par l'orbitale 2p, pour finalement atterrir dans l'orbitale 3s. Puisque les orbitales 2p peuvent occuper 6 électrons, et les 3s 2 électrons, nous avons: 1sdeux2 sdeux2 P63 sdeux.
Il manque encore 3 électrons supplémentaires, qui occupent l'orbitale 3p suivante selon le diagramme de Moeller: 1sdeux2 sdeux2 P63 sdeux3p3, configuration électronique du luminophore [P].
Zirconium
L'élément zirconium a un Z = 40. Raccourcir le chemin avec la configuration 1sdeux2 sdeux2 P63 sdeux3p6, avec 18 électrons (celui de l'argon de gaz rare), il manquerait alors 22 électrons supplémentaires. Après l'orbitale 3p, les prochaines à remplir selon le diagramme de Moeller sont les orbitales 4s, 3d, 4p et 5s.
Les remplir complètement, c'est-à-dire 4sdeux, 3ddix, 4p6 et 5sdeux, un total de 20 électrons sont ajoutés. Les 2 électrons restants sont donc logés dans l'orbitale suivante: la 4d. Ainsi, la configuration électronique du zirconium, [Zr] est: 1sdeux2 sdeux2 P63 sdeux3p64 sdeux3ddix4p65 sdeux4jdeux.
Iridium
L'iridium a un Z = 77, il a donc 37 électrons supplémentaires par rapport au zirconium. À partir de [Cd], c'est-à-dire 1sdeux2 sdeux2 P63 sdeux3p64 sdeux3ddix4p65 sdeux4jdix, ajouter 29 électrons avec les orbitales suivantes du diagramme de Moeller.
En dessinant de nouvelles diagonales, les nouvelles orbitales sont: 5p, 6s, 4f et 5d. En remplissant complètement les trois premières orbitales, nous avons: 5p6, 6 sdeux et 4f14, pour donner un total de 22 électrons.
Il manque donc 7 électrons, qui sont dans l'orbitale 5d: 1s.deux2 sdeux2 P63 sdeux3p64 sdeux3ddix4p65 sdeux4jdix5 p66 sdeux4f145 j7.
Ce qui précède est la configuration électronique de l'iridium, [Go]. Notez que les orbitales 6sdeux et 5d7 sont surlignés en gras pour indiquer qu'ils correspondent bien à la couche de valence de ce métal.
Exceptions au diagramme de Moeller et à la règle de Madelung
De nombreux éléments du tableau périodique n'obéissent pas à ce qui vient d'être expliqué. Leurs configurations électroniques diffèrent expérimentalement de celles prédites pour des raisons quantiques..
Entre los elementos que presentan estas discordancias son: cromo (Z=24), cobre (Z=29), plata (Z=47), rodio (Z=45), cerio (Z=58), niobio (Z=41) et beaucoup plus.
Les exceptions sont très fréquentes dans le remplissage des orbitales d et f. Par exemple, chrome doit avoir un paramètre de valence de 4 sdeux3d4 selon le diagramme de Moeller et la règle de Madelung, mais c'est en fait 4s13d5.
De plus, et enfin, le réglage de la valence argentée devrait être de 5sdeux4j9; mais c'est vraiment 5s14jdix.
Les références
- Gavira J. Vallejo M. (6 août 2013). Exceptions à la règle de Madelung et au diagramme de Moeller dans la configuration électronique des éléments chimiques. Récupéré de: triplenlace.com
- Ma superclasse. (s.f.) Qu'est-ce que la configuration électronique? Récupéré de: misuperclase.com
- Wikipédia. (2018). Diagramme de Moeller. Récupéré de: es.wikipedia.org
- Nuls. (2018). Comment représenter les électrons dans un diagramme de niveau d'énergie. Récupéré de: dummies.com
- Nave R. (2016). Ordre de remplissage des états électroniques. Récupéré de: hyperphysics.phy-astr.gsu.edu



Personne n'a encore commenté ce post.