
Caractéristiques et exemples de liaisons covalentes polaires

UNE liaison covalente polaire C'est celui formé entre deux éléments chimiques dont la différence d'électronégativité est importante, mais sans se rapprocher d'un caractère purement ionique. Il s'agit donc d'une forte interaction intermédiaire entre les liaisons covalentes apolaires et les liaisons ioniques..
On dit qu'elle est covalente parce qu'en théorie il y a un partage égal d'une paire électronique entre les deux atomes liés; c'est-à-dire que les deux électrons sont partagés également. L'atome E donne un électron, tandis que X contribue au deuxième électron pour former la liaison covalente E: X ou E-X.
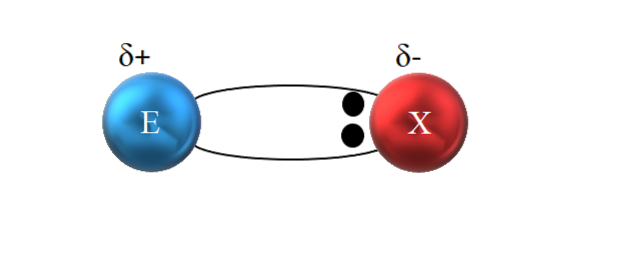
Cependant, comme on le voit sur l'image ci-dessus, les deux électrons ne sont pas situés au centre de E et X, indiquant qu'ils "circulent" avec la même fréquence entre les deux atomes; ils sont plutôt plus proches de X que de E. Cela signifie que X a attiré la paire d'électrons vers lui en raison de son électronégativité plus élevée.
Comme les électrons de la liaison sont plus proches de X que de E, autour de X une région de haute densité électronique est créée, δ-; tandis que dans E apparaît une région pauvre en électrons, δ +. Il existe donc une polarisation des charges électriques: une liaison covalente polaire.
Index des articles
- 1 Fonctionnalités
- 1.1 Degrés de polarité
- 1.2 Éléments chimiques qui en sont à l'origine
- 1.3 Caractère polaire et ionique
- 2 Exemples de liaison covalente polaire
- 2.1 C-O
- 2,2 H-X
- 2,3 O-H
- 2,4 N-H
- 2,5 Fe-O
- 3 Références
Caractéristiques
Degrés de polarité
Les liaisons covalentes sont très abondantes dans la nature. Ils sont présents dans pratiquement toutes les molécules hétérogènes et composés chimiques; puisque, à la fin, il se forme lorsque deux atomes différents E et X se lient. Cependant, il existe des liaisons covalentes plus polaires que d'autres, et pour le savoir, il faut recourir aux électronégativités.
Plus X est électronégatif et moins E est électronégatif (électropositif), alors la liaison covalente résultante sera plus polaire. La manière conventionnelle d'estimer cette polarité consiste à utiliser la formule:
χX - χET
Où χ est l'électronégativité de chaque atome selon l'échelle de Pauling.
Si cette soustraction ou soustraction a des valeurs comprises entre 0,5 et 2, alors ce sera une liaison polaire. Par conséquent, il est possible de comparer le degré de polarité entre différentes liaisons E-X. Dans le cas où la valeur obtenue est supérieure à 2, on parle d'une liaison ionique, E+X- Et ce n'est pasδ+-Xδ-.
Cependant, la polarité de la liaison E-X n'est pas absolue, mais dépend de l'environnement moléculaire; c'est-à-dire dans une molécule -E-X-, où E et X forment des liaisons covalentes avec d'autres atomes, ces derniers influencent directement ledit degré de polarité.
Les éléments chimiques qui en sont à l'origine
Bien que E et X puissent être n'importe quel élément, tous ne provoquent pas de liaisons covalentes polaires. Par exemple, si E est un métal hautement électropositif, comme les métaux alcalins (Li, Na, K, Rb et Cs), et X est un halogène (F, Cl, Br et I), ils auront tendance à former des composés ioniques (N / A+Cl-) et pas de molécules (Na-Cl).
C'est pourquoi des liaisons covalentes polaires se trouvent généralement entre deux éléments non métalliques; et dans une moindre mesure, entre les éléments non métalliques et certains métaux de transition. Regarder le bloc p du tableau périodique, vous avez de nombreuses options pour former ces types de liaisons chimiques.
Caractère polaire et ionique
Dans les grosses molécules, il n'est pas très important de penser à la polarité d'une liaison; Celles-ci sont hautement covalentes et la distribution de leurs charges électriques (là où se trouvent les régions riches ou pauvres en électrons) attire plus l'attention que la définition du degré de covalence de leurs liaisons internes..
Cependant, avec des molécules diatomiques ou de petites molécules, ladite polarité Eδ+-Xδ- c'est assez relatif.
Ce n'est pas un problème avec les molécules formées entre des éléments non métalliques; Mais lorsque les métaux de transition ou métalloïdes participent, on ne parle plus seulement d'une liaison covalente polaire, mais d'une liaison covalente avec un certain caractère ionique; et dans le cas des métaux de transition, d'une liaison de coordination covalente compte tenu de sa nature.
Exemples de liaison covalente polaire
CO
La liaison covalente entre le carbone et l'oxygène est polaire, car la première est moins électronégative (χC = 2,55) que la seconde (χOU ALORS = 3,44). Par conséquent, lorsque nous voyons les liaisons C-O, C = O ou C-O-, nous saurons que ce sont des liaisons polaires.
H-X
Les halogénures d'hydrogène, HX, sont des exemples idéaux pour comprendre la liaison polaire dans vos molécules diatomiques. Avoir l'électronégativité de l'hydrogène (χH = 2.2), nous pouvons estimer la polarité de ces halogénures les uns par rapport aux autres:
-HF (H-F), χF (3,98) - χH (2,2) = 1,78
-HCl (H-Cl), χCl (3,16) - χH (2,2) = 0,96
-HBr (H-Br), χBr (2,96) - χH (2,2) = 0,76
-HI (H-I), χje (2,66) - χH (2,2) = 0,46
Notez que selon ces calculs, la liaison H-F est la plus polaire de toutes. Or, quel est son caractère ionique exprimé en pourcentage, c'est une autre affaire. Ce résultat n'est pas surprenant car le fluor est l'élément le plus électronégatif de tous..
Lorsque l'électronégativité passe du chlore à l'iode, les liaisons H-Cl, H-Br et H-I deviennent également moins polaires. La liaison H-I doit être apolaire, mais elle est en fait polaire et également très "cassante"; se brise facilement.
OH
La liaison polaire O-H est peut-être la plus importante de toutes: grâce à elle, la vie existe, puisqu'elle collabore avec le moment dipolaire de l'eau. Si nous estimons la différence entre les électronégativités de l'oxygène et des hydrogènes, nous aurons:
χOU ALORS (3,44) - χH (2,2) = 1,24
Cependant, la molécule d'eau, HdeuxOu, vous avez deux de ces liaisons, H-O-H. Ceci, ainsi que la géométrie angulaire de la molécule et son asymétrie, en font un composé hautement polaire..
N-H
La liaison N-H est présente dans les groupes amino des protéines. En répétant le même calcul que nous avons:
χN (3,04) - χH (2,2) = 0,84
Cela reflète que la liaison N-H est moins polaire que O-H (1,24) et F-H (1,78).
Moche
La liaison Fe-O est importante car ses oxydes se trouvent dans les minéraux de fer. Voyons s'il est plus polaire que H-O:
χOU ALORS (3,44) - χFoi (1,83) = 1,61
On suppose donc à juste titre que la liaison Fe-O est plus polaire que la liaison H-O (1,24); ou ce qui revient à dire: Fe-O a un caractère ionique plus grand que H-O.
Ces calculs sont utilisés pour déterminer les degrés de polarité entre les différentes liaisons; mais ils ne suffisent pas pour déterminer si un composé est ionique, covalent ou son caractère ionique.
Les références
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Laura Nappi. (2019). Obligations covalentes polaires et non polaires: définitions et exemples. Étude. Récupéré de: study.com
- Helmenstine, Anne Marie, Ph.D. (18 septembre 2019). Définition et exemples de liaison polaire (liaison covalente polaire). Récupéré de: thinkco.com
- Elsevier B.V. (2019). Liaison covalente polaire. ScienceDirect. Récupéré de: sciencedirect.com
- Wikipédia. (2019). Polarité chimique. Récupéré de: en.wikipedia.org
- Anonyme. (05 juin 2019). Propriétés des liaisons covalentes polaires. Chimie LibreTexts. Récupéré de: chem.libretexts.org



Personne n'a encore commenté ce post.