
Structure du fluorure de lithium, propriétés, obtention, utilisations

le fluorure de lithium c'est un solide inorganique dont la formule chimique est LiF. Il est composé d'ions Li+ et F- qui sont liés par une liaison ionique. On le trouve en petites quantités dans divers minéraux, en particulier les silicates comme la lépidolite, dans l'eau de mer et dans de nombreux puits minéraux.
Il a été largement utilisé dans les dispositifs optiques en raison de sa transparence dans une large gamme de longueurs d'onde, du spectre infrarouge (IR) aux ultraviolets UV, en passant par le visible.

Il a également été utilisé dans des appareils pour détecter les rayonnements dangereux dans les emplois où les gens y sont exposés pendant une courte période. De plus, il est utilisé comme matériau pour fondre l'aluminium ou pour fabriquer des verres pour verres ou verres et dans la fabrication de céramiques..
Sert de matériau de revêtement pour les composants de la batterie au lithium-ion et pour éviter la perte initiale de charge des batteries.
Index des articles
- 1 Structure
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Point de fusion
- 3.4 Point d'ébullition
- 3.5 Densité
- 3.6 Indice de réfraction
- 3.7 Solubilité
- 3.8 Autres propriétés
- 4 Collecte et localisation
- 5 utilisations
- 5.1 Dans les applications optiques
- 5.2 Dans les détecteurs de rayonnements ionisants ou dangereux
- 5.3 En tant que matériau pour prélitérer la cathode des batteries au lithium
- 5.4 Dans diverses utilisations
- 6 Références
Structure
Le fluorure de lithium est un composé ionique, c'est-à-dire formé par l'union du cation Li+ et l'anion F-. La force qui les maintient ensemble est électrostatique et s'appelle la liaison ionique..
Lorsque le lithium se combine, il cède un électron au fluor, laissant les deux sous une forme plus stable que la forme initiale, comme expliqué ci-dessous.
L'élément lithium a la configuration électronique suivante: [He] 1sdeux 2 s1 et lors du transfert d'un électron, la structure électronique ressemble à ceci: [He] 1sdeux ce qui est beaucoup plus stable.
L'élément fluor dont la configuration électronique est: [Ne] 1sdeux 2 sdeux 2 P5, lors de l'acceptation de l'électron, il reste de la forme [Ne] 1sdeux 2 sdeux 2 P6, plus stable.
Nomenclature
- Fluorure de lithium
- Fluorolithium
- Monofluorure de lithium
Propriétés
État physique
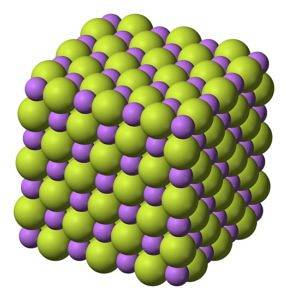
Solide blanc, qui cristallise en structure cubique, comme le chlorure de sodium NaCl.
Poids moléculaire
26 g / mol
Point de fusion
848,2 ºC
Point d'ébullition
1673 ºC, bien qu'il se volatilise à 1100-1200 ºC
Densité
2 640 g / cm3
Indice de réfraction
1,3915
Solubilité
Légèrement soluble dans l'eau: 0,27 g / 100 g d'eau à 18 ºC; 0,134 g / 100 g à 25 ° C Soluble en milieu acide. Insoluble dans l'alcool.
Autres propriétés
Ses vapeurs présentent des espèces dimères (LiF)deux et trimérique (LiF)3. Avec l'acide fluorhydrique, HF forme du bifluorure de lithium LiHFdeux; avec l'hydroxyde de lithium forme un sel double LiF. LiOH.
Collecte et localisation
Le fluorure de lithium LiF peut être obtenu par réaction entre l'acide fluorhydrique HF et l'hydroxyde de lithium LiOH ou le carbonate de lithium LideuxCO3.
Cependant, il est présent en petites quantités dans certains minéraux comme la lépidolite et dans l'eau de mer..

Applications
Dans les applications optiques
Le LiF est utilisé sous forme de cristaux compacts dans les spectrophotomètres infrarouges (IR) en raison de l'excellente dispersion qu'ils présentent dans la gamme de longueurs d'onde entre 4000 et 1600 cm-1.
De gros cristaux de LiF sont obtenus à partir de solutions saturées de ce sel. Peut remplacer les cristaux de fluorite naturels dans divers types d'appareils optiques.
De gros cristaux purs sont utilisés dans les systèmes optiques pour la lumière ultraviolette (UV), visible et IR et dans les monochromateurs à rayons X (0,03-0,38 nm).

Il est également utilisé comme matériau de revêtement optique pour la région UV en raison de sa large bande optique, supérieure à celle des autres fluorures métalliques..
Sa transparence dans les UV lointains (90-200 nm) le rend idéal comme revêtement protecteur sur les miroirs en aluminium (Al). Les miroirs LiF / Al sont utilisés dans les systèmes de télescope optique pour des applications dans l'espace.
Ces revêtements sont réalisés par dépôt physique en phase vapeur et dépôt de couche au niveau atomique..
Dans les détecteurs de rayonnements ionisants ou dangereux
Le fluorure de lithium a été largement utilisé dans les détecteurs thermoluminescents pour le rayonnement de photons, de neutrons et de particules β (bêta)..
Les détecteurs thermoluminescents économisent l'énergie du rayonnement lorsqu'ils y sont exposés. Plus tard, lorsqu'ils sont chauffés, ils libèrent l'énergie stockée sous forme de lumière..
Pour cette application, le LiF est généralement dopé avec des impuretés de magnésium (Mg) et de titane (Ti). Ces impuretés génèrent certains niveaux d'énergie qui agissent comme des trous où les électrons libérés par le rayonnement sont piégés. Lorsque le matériau est ensuite chauffé, ces électrons reviennent à leur état d'énergie d'origine, émettant de la lumière.
L'intensité de la lumière émise dépend directement de l'énergie absorbée par le matériau.
Les détecteurs LiF thermoluminescents ont été testés avec succès pour mesurer des champs de rayonnement complexes, tels que ceux présents dans le grand collisionneur de hadrons, ou LHC. Grand collisionneur de hadrons), situé au sein de l'Organisation européenne pour la recherche nucléaire, connue sous le nom de CERN (pour son acronyme du français Conseil Européen pour la Recherche Nucléaire).
Le rayonnement dans les expériences menées dans ce centre de recherche présente des hadrons, des neutrons et des électrons / positrons, entre autres types de particules subatomiques, qui peuvent tous être détectés avec LiF.
En tant que matériau pour prélitérer la cathode des batteries au lithium
Le LiF a été testé avec succès sous forme de nanocomposites avec du cobalt (Co) et du fer (Fe) comme matériaux de prélitiation. prélithiation) du matériau cathodique des batteries lithium-ion.
Au cours du premier cycle de charge ou étape de formation d'une batterie lithium-ion, l'électrolyte organique se décompose pour former une phase solide à la surface de l'anode..
Ce processus consomme du lithium de la cathode et réduit l'énergie de 5 à 20% de la capacité totale de la batterie lithium-ion..
Pour cette raison, la prélitiation électrochimique de la cathode a été étudiée, ce qui génère une extraction électrochimique du lithium du nanocomposite, qui agit comme un donneur de lithium, évitant ainsi la consommation de lithium de la cathode.
Les nanocomposites LiF / Co et LiF / Fe ont une grande capacité à donner du lithium à la cathode, étant faciles à synthétiser, stables dans les conditions environnementales et le traitement de la batterie.

Dans diverses utilisations
Le fluorure de lithium est utilisé comme flux de soudage, en particulier pour l'aluminium, et dans les revêtements pour baguettes de soudage. Également utilisé dans les cellules de réduction en aluminium.
Il est largement utilisé dans la fabrication de verres (tels que les verres) dans lesquels le coefficient de dilatation diminue. Il est également utilisé dans la fabrication de céramiques. De plus, il est utilisé dans la fabrication d'émaux et de vernis vitreux..
Le LiF est un composant des carburants pour fusées et des carburants pour certains types de réacteurs..
Le LiF est également utilisé dans les diodes électroluminescentes ou les composants photovoltaïques, pour l'injection d'électrons dans les couches internes.
Les références
- Cotton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley et fils.
- NOUS. Bibliothèque nationale de médecine. (2019). Fluorure de lithium. Récupéré de: pubchem.ncbi.nlm.nih.gov.
- Obryk, B. et coll. (2008). La réponse de différents types de détecteurs de fluorure de lithium TL aux champs de rayonnement mixtes à haute énergie. Radiation Measurements 43 (2008) 1144-1148. Récupéré de sciencedirect.com.
- Sun, Y. et coll. (2016). Synthèse chimique in situ de fluorure de lithium / nanocomposite métallique pour la prélithiation de haute capacité des cathodes. Nano Letters 2016, 16, 2, 1497-1501. Récupéré de pubs.acs.org.
- Hennessy, J. et Nikzad, S. (2018). Dépôt de couche atomique de revêtements optiques au fluorure de lithium pour l'ultraviolet. Inorganics 2018, 6, 46. Récupéré de mdpi.com.



Personne n'a encore commenté ce post.