
Caractéristiques et préparation du frottis bactérien
le frottis bactérien est une extension de film mince d'une suspension de micro-organismes bactériens qui est faite sur une plaque ou une lame de verre transparente, pour l'observation au microscope optique.
L'extension sous forme de film est réalisée afin de séparer au maximum les microorganismes, car s'ils sont regroupés l'observation n'est pas claire.
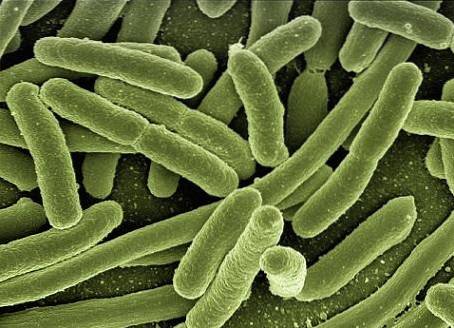
Dans l'étude des cultures bactériennes, des techniques de préparation, de fixation et de coloration des frottis sont utilisées pour mieux les analyser. En raison de la petite taille des micro-organismes, l'utilisation d'un microscope optique est nécessairement nécessaire pour leur observation..
Les microscopes optiques sont des instruments indispensables pour observer les frottis. Ceux-ci utilisent des lentilles optiques et de la lumière permettant la visualisation des échantillons avec un fort grossissement..
En général, les cellules vivantes n'ont pas pour la plupart des structures colorées, vu au microscope optique ce sont des échantillons incolores, transparents, et ils montrent très peu de contraste interne et avec leur environnement..
L'observation avec le simple microscope optique à fond clair, sans l'utilisation de techniques de coloration auxiliaires, est très limitée et n'est utilisée que dans certains cas, comme dans l'observation du mouvement des micro-organismes.
Pour une observation optimale des micro-organismes, un équilibre doit être trouvé entre contraste et résolution. Les détails des cellules ne peuvent pas être vus au microscope, même avec une haute résolution; l'utilisation de colorants est nécessaire grâce à des techniques de coloration, qui fournissent un contraste pour l'observation.
Index des articles
- 1 Caractéristiques d'un frottis bactérien de bonne qualité
- 1.1 Excellent contraste
- 1.2 Bonne fixation
- 1.3 Bonne coloration
- 2 Préparation
- 2.1 A. Frottis
- 2.2 B. Fixation
- 2.3 C. Coloration simple
- 2.4 D. Conservation définitive du frottis
- 3 Références
Caractéristiques d'un frottis bactérien de bonne qualité
Excellent contraste
Pour obtenir un excellent contraste, il existe des microscopes sophistiqués appelés microscope à contraste de phase, microscope à interférence différentielle et microscope à fond noir. Ce type de microscope est utilisé pour observer les structures bactériennes telles que les gaines et les filaments, entre autres..
La coloration est une technique simple pour augmenter le contraste obtenue avec un microscope à fond clair. Dans cette technique, différents colorants peuvent être utilisés qui améliorent considérablement l'observation microscopique..
Les colorations sont effectuées directement sur les frottis ou extensions des suspensions de microorganismes sur les lames, préalablement séchées et fixées..
Bonne solution
La fixation est une technique utilisée pour préserver les structures cellulaires; provoque l'inactivation des microorganismes et l'adhésion au verre de la lame. Il existe différents traitements de fixation: fixation thermique et fixation chimique.
Fixation thermique
C'est la méthode la plus utilisée pour observer les frottis bactériens. La technique consiste à faire passer la suspension bactérienne du frottis à travers la flamme d'un briquet. Cette technique est capable de préserver la morphologie externe des bactéries, mais détruit leurs structures internes..
Fixation chimique
La fixation chimique utilise des produits chimiques de conservation, tels que le formaldéhyde ou le formaldéhyde, l'éthanol et l'acide acétique, entre autres. L'avantage d'utiliser des agents de fixation chimiques est que la préservation des structures cellulaires internes des microorganismes est obtenue..
Bonne coloration
Les procédures les plus courantes pour colorer un frottis préalablement séché et fixé sont la coloration positive ou simple, la coloration différentielle et la coloration négative. Il existe également des techniques spéciales pour la coloration de structures cellulaires particulières (capsule, spore, flagelle).
Coloration positive ou coloration simple
La coloration positive ou simple est la technique de coloration par frottis la plus largement utilisée. Il utilise des colorants qui ont la capacité de se lier à certaines structures microbiennes, leur permettant d'être observées au microscope.
Ces colorants ont des groupes chromophores (partie colorée) dans leur structure chimique, avec alternance de doubles liaisons et de simples liaisons (conjugaison). Ces liaisons peuvent à leur tour établir des liaisons ioniques ou covalentes avec certaines structures cellulaires..
Les colorants utilisés en coloration positive ou simple sont pour la plupart des dérivés chimiques du aniline (sels organiques colorés).
Par contre, parmi les colorants, on peut en trouver certains avec un pH basique et d'autres avec un pH acide..
Colorants de base
Dans les colorants basiques, le groupe chromophore a une charge électrique positive. La grande majorité des micro-organismes procaryotes ont un pH interne neutre et leur surface cellulaire est chargée négativement. Grâce à cette interaction électrostatique, le chromophore se lie à la cellule et la colore.
Des exemples de colorants basiques sont le bleu de méthylène, le cristal violet, le vert malachite, la fuscine basique, la safranine, entre autres..
Colorants acides
Dans les colorants acides, le groupe chromophore a une charge électrique négative. Ceux-ci sont utilisés pour colorer les protéines avec des groupes amino chargés positivement. Des exemples de colorants acides sont la fuscine acide, le rose Bengale, le rouge Congo et l'éosine.
Coloration différentielle
La technique de coloration différentielle consiste à appliquer deux colorants de couleur ou d'intensité différente, pour distinguer différents microorganismes au microscope. La coloration de Gram et la coloration de résistance acide-alcool sont les colorations différentielles les plus largement utilisées en bactériologie.
La coloration de Gram est utilisée comme test préliminaire pour connaître la forme, la taille, le regroupement des cellules, ainsi que le type de paroi cellulaire. En utilisant le test de coloration de Gram, les bactéries de la paroi cellulaire sont classées en bactéries Gram positives et Gram négatives..
Coloration négative
Dans cette technique, des colorants chimiques sont utilisés qui ne pénètrent pas à l'intérieur de la cellule, mais font apparaître le milieu dans lequel les micro-organismes sont un fond noir..
Dans la technique de coloration négative, le frottis est réalisé avec une goutte d'encre de Chine ou de suspension de nigrosine qui, après avoir laissé sécher à température ambiante, forme un film opaque au passage de la lumière. De cette façon, les micro-organismes sont vus comme des formes lumineuses sur un fond sombre..
préparation
A. Frottis
1.- Lavez bien les lames, séchez-les avec du papier absorbant et étiquetez-les. L'étiquette doit indiquer le contenu de la préparation, la date et le nom de la personne qui l'a traitée..
2.- Allumez le briquet et stérilisez la boucle d'inoculation dans la flamme jusqu'à ce qu'elle soit rouge vif.
3.- Laisser refroidir la poignée.
4.- Prenez le tube de culture bactérienne, retirez le capuchon et passez rapidement l'embouchure du tube près de la flamme du brûleur (flamme).
5.- Insérez la boucle d'inoculation dans le tube contenant la culture bactérienne et prélevez l'échantillon.
6.- Si la culture est en milieu liquide, placez l'échantillon prélevé avec la poignée au centre de la lame et étalez-le soigneusement dans un cercle d'environ 2 cm de diamètre..
7.- Stérilisez à nouveau la boucle d'inoculation.
8.- Laisser sécher le frottis à l'air.
9.- Répétez les étapes 3 à 8 trois fois.
10.- Si la culture est en milieu solide, une goutte d'eau distillée doit être préalablement déposée sur la lame. Ceci est fait pour mélanger un petit échantillon de la culture prélevé avec la boucle d'inoculation, comme indiqué dans les étapes 2 à 5 (conditions aseptiques).
11.- Étalez l'échantillon dilué avec la goutte d'eau sur la lame et répétez trois fois.
B. Fixation
1.- Ajouter deux gouttes de méthanol ou d'éthanol absolu aux frottis secs de cultures en milieu liquide..
2.- Laisser sécher à l'air loin du briquet.
3.- Si le frottis provient d'une culture sur milieu solide, le frottis sec est fixé à la chaleur en le passant 2 à 3 fois rapidement à travers la partie la plus chaude de la flamme du briquet..
4.- Touchez la partie inférieure du frottis avec la partie dorsale de la main gauche (pour les droitiers; sinon, utilisez la main droite) et vérifiez qu'elle est froide.
C. Coloration simple
1.- Ajouter 2 gouttes de la tache sélectionnée au frottis et laisser agir le temps requis dans les protocoles spécifiques pour chaque tache (généralement entre 1 et 5 minutes).
2.- Certaines taches nécessitent l'utilisation de chaleur pour leur activation, auquel cas il faut être très prudent lors du chauffage de la lame dans la flamme du briquet (la manipuler avec une pince à épiler et éviter l'ébullition). Une surchauffe du frottis peut détruire les cellules à observer..
3.- Retirer l'excès de colorant en lavant à l'eau distillée d'une picette. Retirez l'eau de lavage en tapotant doucement la glissière sur son bord, inclinée sur la table de travail.
4.- Laisser sécher à l'air.
5.- Selon le type d'observation, une lamelle est utilisée ou non à ce stade. La lamelle couvre et préserve le frottis. Si une observation d'immersion dans l'huile est effectuée à ce stade, aucune lamelle n'est utilisée mais le frottis ne peut pas être préservé.
D. Conservation définitive du frottis
1.- Immerger successivement le frottis dans chacune des solutions indiquées ci-dessous, pendant au moins 5 minutes. Le but de ces "bains" est de laisser le frottis complètement déshydraté. Chaque réactif doit être bien drainé avant d'introduire le frottis dans le bain suivant..
L'ordre des bains de déshydratation est le suivant:
- Éthanol 70%
- Éthanol 95%
- Acétone pure
- Mélange acétone -xylol 1: 1
- Xylol
Ensuite, laissez sécher à l'air.
2.- Montez la lamelle, de préférence 22 × 22 mm, en utilisant du baume du Canada ou un autre support de montage.
Les références
- Briggs, G. (1965). Facteurs causaux des accidents et infections microbiologiques de laboratoire. Laboratoires biologiques de l'armée américaine. Fort Detrick.
- Cappucino, J.G. et Welch, C.T. (2017). Microbiologie: un manuel de laboratoire. Pearson.
- Holt, J.G. Éditeur. (1977). Le manuel plus court de Bergey sur la bactériologie déterminative. 8e Baltimore: The Williams and Wilkins Co.
- Johnson, T.R. et cas; C.L. (2018). Expériences de laboratoire en microbiologie. Pearson.
- Tille, P. (2017). Microbiologie diagnostique. 14e Saint-Louis, États-Unis: Elsiever, Inc.
Personne n'a encore commenté ce post.