
Caractéristiques, structure, fonctions de la fucose
La fucose (abrégé Fuc), ou 6-L-désoxy-galactose, est un monosaccharide à six carbones partiellement désoxygéné (désoxysucre) dont la formule empirique est C6H12OU ALORS5. Comme les autres monosaccharides, c'est un sucre polyhydrique.
Lorsqu'un groupe hydroxyle est remplacé par un atome d'hydrogène, un désoxysucre est dérivé. Bien que théoriquement ce remplacement puisse affecter n'importe quel groupe hydroxyle de n'importe quel monosaccharide, dans la nature, il y a peu de variété de désoxysucres.
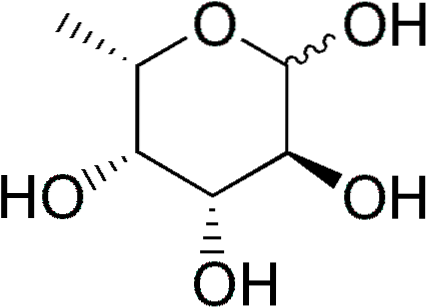
Certains désoxysucres sont: 1) le désoxyribose (2-désoxy-D-ribose), dérivé du D-ribose, qui fait partie de l'ADN; 2) le rhamnose (6-D-désoxymannose), dérivé du D-mannose; 3) le fucose, dérivé du L-galactose. Ce dernier est plus courant que le D-fucose, dérivé du D-galactose.
Index des articles
- 1 Caractéristiques et structure
- 2 Distribution dans la nature
- 3 Métabolisme du fucose
- 4 fonctions
- 4.1 Rôle dans le cancer
- 4.2 Rôle dans d'autres maladies
- 4.3 Potentiel biomédical
- 5 Références
Caractéristiques et structure
Le fucose est également connu sous les noms de 6-désoxy-galacto-hexose, fucopyranose, galactométhylose et rodéose..
Bien que normalement présent dans la formation de polysaccharides et de glycoprotéines, isolé sous forme de monosaccharide, il est plus sucré que le galactose. Cela est dû au fait que le remplacement d'un groupe hydroxyle par un atome d'hydrogène augmente le caractère hydrophobe et, par conséquent, la douceur de la molécule..
Les groupes hydroxyle du fucose peuvent subir les mêmes réactions que les autres sucres, produisant une grande variété d'acétals, de glycosides, d'éthers et d'esters..
Une biomolécule fucosylée est une biomolécule à laquelle, par l'action d'une fucosyltransférase, des molécules de fucose se sont fixées par des liaisons glycosidiques. Lorsque l'hydrolyse des liaisons glycosidiques se produit par l'action d'une fucosidase, séparant ainsi le fucose, la biomolécule est dite défucosylée.
Lorsque les glucanes sont fucosylés, des glucanes plus complexes appelés fucanes sont générés, qui peuvent ou non faire partie des glycoprotéines. Les fucanes sulfatés sont définis comme les polysaccharides qui contiennent des résidus L-fucose sulfatés. Ils sont typiques des algues brunes. Les exemples incluent l'ascophylane, le sargasan et le pelvetan..
L'un des fucanes les mieux étudiés est le fucoïdane, obtenu à partir d'algues brunes Fucus vesiculosus, commercialisé (Sigma-Aldrich Chemical Company) depuis des décennies.
Distribution dans la nature
Le D-fucose est présent dans les substances antibiotiques produites par les microbes et dans les glycosides végétaux, tels que la convolvuline, la chartreusine, le ledienoside et la keirotoxine.
Le L-fucose est un constituant de polysaccharides provenant d'algues, de feuilles de prunier, de lin, de graines de soja et de canola, de gomme adragante, de parois cellulaires de pomme de terre, de tubercules de manioc, de kiwi, de l'écorce de ceiba et du mucigel du maïs caliptra, ainsi que autres plantes.
Le L-fucose est également présent dans les œufs d'oursin et dans la gélatine qui protège les œufs de grenouille.
Chez les mammifères, les fucanes avec L-fucose forment les ligands qui agissent sur l'adhésion leucocytaire-endothéliale médiée par la sélectine et participent à de nombreux événements ontogénétiques.
Le L-fucose est abondant dans les fucosphingolipides de l'épithélium gastro-intestinal et de la moelle osseuse, et apparaît en petites proportions dans le cartilage et les structures kératiniques.
Chez l'homme, le L-fucose fucane fait partie des glycoprotéines présentes dans la salive et les sucs gastriques. Ils font également partie des antigènes qui définissent les groupes sanguins ABO. Ils sont présents dans divers oligosaccharides du lait maternel.
Métabolisme du fucose
Les fucosyltransférases utilisent le GDP-fucose, une forme de fucose activée par les nucléotides, comme donneur de fucose dans la construction d'oligosaccharides fucosylés.
Le GDP-fucose est dérivé du GDP-mannose par l'action successive de deux enzymes: GDP-mannose 4,6-déshydratase et GDP-4-céto-6-désoximanose 3,5-épimérase-4-réductase.
En utilisant un cofacteur NADP +, la première enzyme catalyse la déshydratation du GDP-mannose. La réduction de la position 6 et l'oxydation de la position 4 produisent du PIB-6-désoxy-4-céto-mannose (pendant la réaction, l'hybride est transféré de la position 4 à 6 du sucre).
La deuxième enzyme, qui dépend du NADPH, catalyse l'épimérisation des positions 3 et 5, et la réduction du groupe 4-céto, du GDP-6-désoxy-4-céto-mannose..
Les bactéries peuvent se développer en utilisant le fucose comme seule source de carbone et d'énergie au moyen d'un opéron inductible par le fucose qui code les enzymes cataboliques pour ce sucre..
Le processus ci-dessus implique: 1) l'entrée de fucose libre à travers la paroi cellulaire médiée par une perméase; 2) isomérisation du fucose (un aldose) pour former du fuculose (une cétose); 3) la phosphorylation de la fuculose pour former du fuculose-1-phosphate; 4) une réaction d'aldolase pour former du lactaldéhyde et du phosphate de dihydroxyacétone à partir de fuculose-1-phosphate.
Caractéristiques
Rôle dans le cancer
Les symptômes de nombreux types de tumeurs cancéreuses comprennent la présence de protéines liées au glucane qui se distinguent par une composition oligosaccharidique modifiée. La présence de ces glucanes anormaux, parmi lesquels se distinguent les fucanes, est liée à la malignité et au potentiel métastatique de ces tumeurs.
Dans le cancer du sein, les cellules tumorales incorporent du fucose dans les glycoprotéines et les glycolipides. Le fucose contribue à la progression de ce cancer, favorisant l'activation des cellules souches cancéreuses, les métastases hématogènes et l'invasion des tumeurs au travers des matrices extracellulaires.
Dans le carcinome pulmonaire et l'hépatocarcinogenèse, une expression accrue du fucose est associée à un potentiel métastatique élevé et une faible probabilité de survie.
En revanche, certains fucanes sulfatés sont des substances prometteuses dans le traitement du cancer, comme cela a été déterminé par de nombreuses études in vitro avec des lignées cellulaires cancéreuses, y compris celles qui causent le cancer du sein, du poumon, de la prostate, de l'estomac, du colon et du rectum..
Rôle dans d'autres maladies
Une expression accrue des fucanes dans les immunoglobulines sériques a été associée à la polyarthrite rhumatoïde juvénile et adulte.
Le déficit d'adhésion leucocytaire II est une maladie congénitale rare due à des mutations qui altèrent l'activité d'un transporteur FDP-fucose situé dans l'appareil de Golgi.
Les patients souffrent d'un retard mental et psychomoteur et souffrent d'infections bactériennes récurrentes. Cette maladie répond favorablement aux doses orales de fucose.
Potentiel biomédical
Les fucanes sulfatés obtenus à partir d'algues brunes sont d'importants réservoirs de composés à potentiel thérapeutique.
Ils ont des propriétés anti-inflammatoires et antioxydantes, inhibant la migration des lymphocytes aux sites infectieux et favorisant la libération de cytokines. Augmente la réponse immunitaire en activant les lymphocytes et les macrophages.
Ils ont des propriétés anticoagulantes. Il a été démontré par voie orale qu'elle inhibe l'agrégation plaquettaire chez les patients humains.
Ils ont un potentiel antibiotique et antiparasitaire et inhibent la croissance des bactéries pathogènes de l'estomac Helicobacter pylori. Tuer les parasites Plasmodium spp. (agent causal du paludisme) et Leishmania donovani (agent causal de la leishmaniose viscérotrope américaine).
Enfin, ils possèdent de puissantes propriétés antivirales, inhibant l'entrée dans la cellule de plusieurs virus d'une grande importance pour la santé humaine, notamment Arénavirus, Cytomégalovirus, Hantavirus, Hépadnavirus, VIH, virus de l'herpès simplex et virus de la grippe.
Les références
- Becker, D. J., Lowe, J. B. 2003. Fucose: biosynthèse et fonction biologique chez les mammifères. Glycobiologie, 13, 41R-53R.
- Deniaud-Bouët, E., Hardouin, K., Potin, P., Kloareg, B., Hervé, C. 2017. Une revue sur les parois cellulaires des algues brunes et les polysaccharides sulfatés contenant du fucose: contexte de la paroi cellulaire, propriétés biomédicales et clé défis de la recherche Polymères glucidiques, http://dx.doi.org/10.1016/j.carbpol.2017.07.082.
- Fleurs H. M. 1981. Chimie et biochimie du D- et L-fucose. Progrès de la chimie et de la biochimie des glucides, 39, 279-345.
- Listinsky, J. J., Siegal, G. P., Listinsky, C. M. 2011. L'importance émergente de α-L-fucose dans le cancer du sein humain: une revue. Am. J. Transl. Res., 3, 292-322.
- Murray, R. K. et coll. 2003. La biochimie illustrée de Harper. McGraw-Hill, État de New York.
- Pereira, L. 2018. Utilisations thérapeutiques et nutritionnelles des algues. CRC Press, Boca Raton.
- Staudacher, E., Altmann, F., Wilson, I. B. H., März, L. 1999. Fucose dans les N-glycanes: de la plante à l'homme. Biochimica et Biophysica Acta, 1473, 216-236.
- Tanner, W., Loewus, F. A. 1981. Glucides végétaux II. Glucides extracellulaires. Springer, État de New York.
- Vanhooren, P. T., Vandamme, E. J. 1999. L-fucose: occurrence, rôle physiologique, synthèse chimique, enzymatique et microbienne. Journal of Chemical Technology and Biotechnology, 74, 479-497.



Personne n'a encore commenté ce post.