
Caractéristiques et exemples des forces de Londres
le Forces de Londres, Les forces de diffusion de Londres, ou interactions dipôle-dipôle induites, sont le type le plus faible d'interactions intermoléculaires. Son nom est dû aux contributions du physicien Fritz London et à ses études dans le domaine de la physique quantique.
Les forces de Londres expliquent comment les molécules interagissent dont les structures et les atomes lui empêchent de former un dipôle permanent; c'est-à-dire qu'elle s'applique fondamentalement aux molécules apolaires ou aux atomes isolés de gaz nobles. Contrairement aux autres forces de Van der Waals, celle-ci nécessite des distances extrêmement courtes.

Une bonne analogie physique des forces de Londres peut être trouvée dans le fonctionnement du système de fermeture Velcro (image ci-dessus). En appuyant sur un côté du tissu brodé avec des crochets et sur l'autre avec des fibres, une force attractive est créée qui est proportionnelle à la surface des tissus.
Une fois les deux faces scellées, une force doit être exercée pour contrecarrer leurs interactions (effectuées par nos doigts) pour les séparer. Il en va de même pour les molécules: plus elles sont volumineuses ou plates, plus leurs interactions intermoléculaires sont importantes à de très courtes distances..
Cependant, il n'est pas toujours possible d'approcher ces molécules à une distance suffisamment proche pour que leurs interactions soient appréciables..
Lorsque c'est le cas, ils nécessitent des températures très basses ou des pressions très élevées; comme tel est le cas des gaz. De même, ces types d'interactions peuvent être présents dans des substances liquides (telles que le n-hexane) et des substances solides (telles que l'iode)..
Index des articles
- 1 Fonctionnalités
- 1.1 Répartition homogène de la charge
- 1.2 Polarisabilité
- 1.3 Il est inversement proportionnel à la distance
- 1.4 Il est directement proportionnel à la masse moléculaire
- 2 Exemples de forces londoniennes
- 2.1 Dans la nature
- 2.2 Alcanes
- 2.3 Halogènes et gaz
- 3 Références
Caractéristiques
Quelles caractéristiques une molécule doit-elle avoir pour pouvoir interagir avec les forces de Londres? La réponse est que n'importe qui peut le faire, mais quand il y a un moment dipolaire permanent, les interactions dipôle-dipôle prédominent plus que les interactions de diffusion, contribuant très peu à la nature physique des substances..
Dans les structures où il n'y a pas d'atomes hautement électronégatifs ou dont la distribution de charge électrostatique est homogène, il n'y a pas d'extrême ou de région qui puisse être considérée comme riche (δ-) ou pauvre (δ +) en électrons.
Dans ces cas, d'autres types de forces doivent intervenir ou sinon ces composés ne pourraient exister qu'en phase gazeuse, quelles que soient les conditions de pression ou de température opérant sur eux..
Répartition homogène de la charge
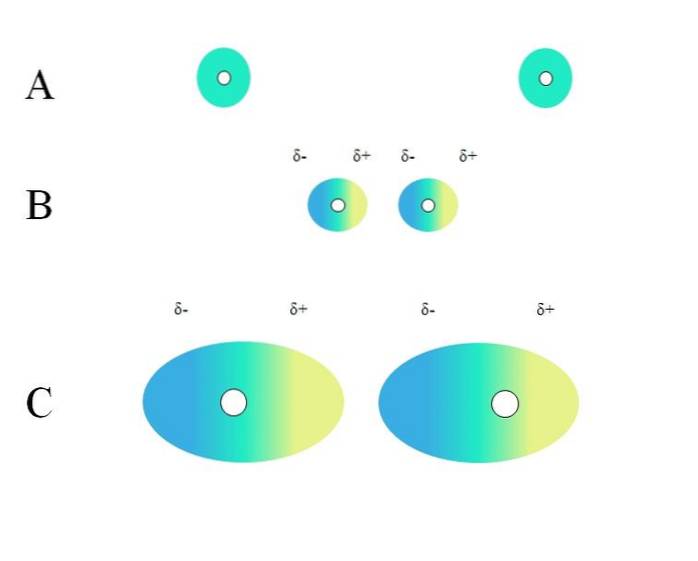
Deux atomes isolés, tels que le néon ou l'argon, ont une distribution de charge homogène. Cela peut être vu dans A, image du haut. Les cercles blancs au centre représentent les noyaux, pour les atomes, ou le squelette moléculaire, pour les molécules. Cette distribution de charge peut être considérée comme un nuage d'électrons vert.
Pourquoi les gaz rares respectent cette homogénéité? Parce qu'ils ont leur coque électronique complètement pleine, leurs électrons devraient théoriquement ressentir la charge attractive du noyau de la même manière dans toutes les orbitales..
En revanche, pour d'autres gaz, comme l'oxygène atomique (O), sa coquille est incomplète (ce qui s'observe dans sa configuration électronique) et l'oblige à former la molécule diatomique Odeux pour compenser cette carence.
Les cercles verts en A peuvent également être des molécules, petites ou grandes. Son nuage d'électrons tourne autour de tous les atomes qui le composent, en particulier les plus électronégatifs. Autour de ces atomes le nuage sera concentré et sera plus négatif, tandis que d'autres atomes auront un déficit électronique.
Cependant, ce nuage n'est pas statique mais dynamique, donc à un moment donné de brèves régions δ- et δ + se formeront, et un phénomène appelé Polarisation.
Polarisabilité
En A, le nuage vert indique une distribution homogène de charge négative. Cependant, la force d'attraction positive exercée par le noyau peut osciller sur les électrons. Cela provoque une déformation du nuage, créant ainsi des régions δ-, en bleu, et δ +, en jaune..
Ce moment dipolaire soudain dans l'atome ou la molécule peut déformer un nuage d'électrons adjacent; en d'autres termes, il induit un dipôle soudain sur son voisin (B, image du haut).
En effet, la région δ- perturbe le nuage voisin, ses électrons ressentent une répulsion électrostatique et sont orientés au pôle opposé, apparaissant δ+.
Notez comment les pôles positifs s'alignent avec les pôles négatifs, tout comme le font les molécules avec des moments dipolaires permanents. Plus le nuage d'électrons est volumineux, plus le noyau le maintiendra homogène dans l'espace; et aussi, plus sa déformation est grande, comme on peut le voir en C.
Par conséquent, les atomes et les petites molécules sont moins susceptibles d'être polarisés par une particule dans leur environnement. Un exemple de cette situation est illustré par la petite molécule d'hydrogène, Hdeux.
Pour qu'il se condense, ou même plus, se cristallise, il a besoin de pressions exorbitantes pour forcer ses molécules à interagir physiquement..
Il est inversement proportionnel à la distance
Bien que des dipôles instantanés se forment qui en induisent d'autres autour d'eux, ils ne sont pas suffisants pour maintenir les atomes ou les molécules ensemble..
En B il y a une distance ré qui sépare les deux nuages et leurs deux noyaux. Pour que les deux dipôles puissent rester pendant un temps considéré, cette distance ré ça doit être très petit.
Cette condition, caractéristique essentielle des forces londoniennes (rappelez-vous la fermeture Velcro), doit être remplie pour qu'elle ait un effet notable sur les propriétés physiques de la matière..
Une fois ré est petit, le noyau à gauche en B commencera à attirer la région bleue δ- de l'atome ou de la molécule voisine. Cela déformera davantage le nuage, comme on le voit en C (le noyau n'est plus au centre mais à droite). Ensuite, il arrive un moment où les deux nuages se touchent et «rebondissent», mais suffisamment lentement pour les maintenir ensemble pendant un certain temps..
Par conséquent, les forces de Londres sont inversement proportionnelles à la distance ré. En fait, le facteur est égal à ré7, donc une légère variation de la distance entre les deux atomes ou molécules affaiblira ou renforcera la diffusion de Londres.
Il est directement proportionnel à la masse moléculaire
Comment augmenter la taille des nuages pour qu'ils se polarisent plus facilement? Ajout d'électrons, et pour cela le noyau doit avoir plus de protons et de neutrons, augmentant ainsi la masse atomique; ou, en ajoutant des atomes au squelette de la molécule, ce qui à son tour augmenterait sa masse moléculaire
De cette manière, les noyaux ou le squelette moléculaire seraient moins susceptibles de garder le nuage d'électrons uniforme tout le temps. Par conséquent, plus les cercles verts considérés en A, B et C sont grands, plus ils seront polarisables et plus grandes seront également leurs interactions par les forces londoniennes..
Cet effet est clairement observé entre B et C, et pourrait l'être encore plus si les cercles étaient de plus grand diamètre. Ce raisonnement est essentiel pour expliquer les propriétés physiques de nombreux composés en fonction de leurs masses moléculaires..
Exemples de forces londoniennes

Dans la nature
Dans la vie quotidienne, il existe d'innombrables exemples des forces de dispersion de Londres sans s'aventurer dans le monde microscopique en premier lieu..
L'un des exemples les plus courants et les plus surprenants se trouve dans les pattes de reptiles connus sous le nom de geckos (image du haut) et chez de nombreux insectes (également chez Spiderman).
Sur leurs pattes, ils ont des coussinets d'où dépassent des milliers de petits filaments. Dans l'image, vous pouvez voir un gecko posant sur la pente d'un rocher. Pour y parvenir, il utilise les forces intermoléculaires entre la roche et les filaments de ses pattes..
Chacun de ces filaments interagit faiblement avec la surface sur laquelle grimpe le petit reptile, mais comme il y en a des milliers, ils exercent une force proportionnelle à la surface de leurs pattes, suffisamment forte pour qu'ils restent attachés et puissent grimper. Les geckos sont également capables de grimper sur des surfaces lisses et parfaites comme le verre..
Alcanes
Les alcanes sont des hydrocarbures saturés qui interagissent également par les forces londoniennes. Leurs structures moléculaires sont simplement constituées de carbones et d'hydrogènes reliés par des liaisons simples. Étant donné que la différence d'électronégativités entre C et H est très faible, ce sont des composés apolaires.
Ainsi, le méthane, CH4, le plus petit hydrocarbure de tous, il bout à -161,7 ° C. Au fur et à mesure que C et H sont ajoutés au squelette, d'autres alcanes avec des masses moléculaires plus élevées sont obtenus.
De cette manière, de l'éthane (-88,6 ° C), du butane (-0,5 ° C) et de l'octane (125,7 ° C) se forment. Remarquez comment leurs points d'ébullition augmentent à mesure que les alcanes deviennent plus lourds.
En effet, leurs nuages électroniques sont plus polarisables et leurs structures ont une plus grande surface, ce qui augmente le contact entre leurs molécules..
L'octane, bien qu'un composé apolaire, a un point d'ébullition plus élevé que l'eau.
Halogènes et gaz
Les forces de Londres sont également présentes dans de nombreuses substances gazeuses. Par exemple, les molécules de Ndeux, Hdeux, COdeux, Fdeux, Cldeux et tous les gaz rares, interagissent par ces forces, car ils présentent une distribution électrostatique homogène, qui peut subir des dipôles instantanés et donner lieu à des polarisations.
Les gaz rares sont He (hélium), Ne (néon), Ar (argon), Kr (krypton), Xe (xénon) et Rn (radon). De gauche à droite, leurs points d'ébullition augmentent avec l'augmentation des masses atomiques: -269, -246, -186, -152, -108 et -62 ºC.
Les halogènes interagissent également à travers ces forces. Le fluor est un gaz à température ambiante tout comme le chlore. Le brome, avec une masse atomique plus élevée, se trouve dans des conditions normales sous forme de liquide rougeâtre, et l'iode, enfin, forme un solide violet qui se sublime rapidement car il est plus lourd que les autres halogènes.
Les références
- Whitten, Davis, Peck et Stanley. Chimie. (8e éd.). Apprentissage CENGAGE, p. 452-455.
- Angeles Mendez. (22 mai 2012). Forces de dispersion (de Londres). Récupéré de: quimica.laguia2000.com
- Forces de dispersion de Londres. Récupéré de: chem.purdue.edu
- Helmenstine, Anne Marie, Ph.D. (22 juin 2018). 3 Types de forces intermoléculaires. Récupéré de: thinkco.com
- Ryan Ilagan et Gary L. Bertrand. Interactions de dispersion de Londres. Tiré de: chem.libretexts.org
- ChemPages Netorials. Forces de Londres. Récupéré de: chem.wisc.edu
- Kamereon. (22 mai 2013). Geckos: Le gecko et les forces de Van der Waals. Récupéré de: almabiologica.com


Personne n'a encore commenté ce post.