
Types, processus et fonctions de glycosylation des protéines

La glycosylation des protéines Il s'agit d'une modification post-traductionnelle qui consiste en l'ajout de chaînes oligosaccharidiques linéaires ou ramifiées à une protéine. Les glycoprotéines résultantes sont généralement des protéines de surface et des protéines de voie de sécrétion..
La glycosylation est l'une des modifications peptidiques les plus courantes parmi les organismes eucaryotes, mais il a été démontré qu'elle se produit également chez certaines espèces d'archées et de bactéries..
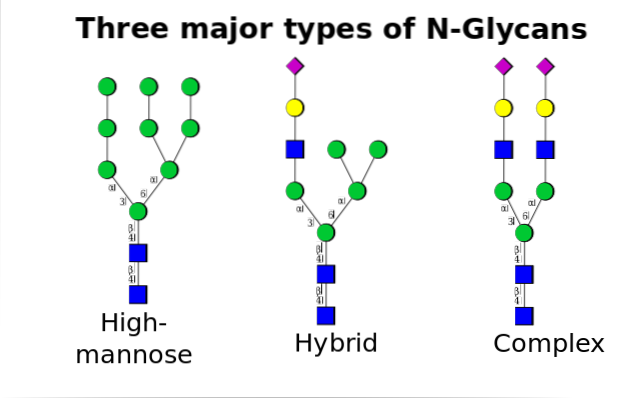
Chez les eucaryotes, ce mécanisme se produit entre le réticulum endoplasmique (RE) et le complexe de Golgi, avec l'intervention de différentes enzymes impliquées à la fois dans les processus de régulation et dans la formation de liaisons covalentes protéine + oligosaccharide..
Index des articles
- 1 Types de glycolyse
- 1.1 N-glycosylation
- 1.2 O-glycosylation
- 1.3 C-mannosylation
- 1.4 Glypiation (de l'anglais "Glypiation")
- 2 Processus
- 2.1 Chez les eucaryotes
- 2.2 Chez les procaryotes
- 3 fonctions
- 3.1 Importance
- 4 Références
Types de glycolyse
En fonction du site de liaison de l'oligosaccharide à la protéine, la glycosylation peut être classée en 4 types:
N-glycosylation
C'est le plus courant de tous et se produit lorsque les oligosaccharides se lient à l'azote du groupe amide des résidus d'asparagine dans le motif Asn-X-Ser / Thr, où X peut être n'importe quel acide aminé sauf la proline.
OU ALORS-glycosylation
Lorsque les glucides sont liés au groupe hydroxyle de la sérine, de la thréonine, de l'hydroxylysine ou de la tyrosine. C'est une modification moins courante et sont des exemples de protéines telles que le collagène, la glycophorine et les mucines..
C-mannosilation
Il consiste en l'ajout d'un résidu mannose qui se lie à la protéine par une liaison C-C avec le C2 du groupe indole dans les résidus tryptophane.
Glipiation (de l'anglais "Glypiation ")
Un polysaccharide agit comme un pont pour attacher une protéine à une ancre glycosylphosphatidylinositol (GPI) sur la membrane.
Traiter
Chez les eucaryotes
La N-la glycosylation est celle qui a été étudiée plus en détail. Dans les cellules de mammifères, le processus commence dans l'ER rugueux, où un polysaccharide préformé se lie aux protéines lorsqu'elles émergent des ribosomes..
Ledit polysaccharide précurseur est composé de 14 résidus sucres, à savoir: 3 résidus glucose (Glc), 9 résidus mannose (Man) et 2 résidus N-acétyl glucosamine (GlcNAc).
Ce précurseur est commun chez les plantes, les animaux et les organismes eucaryotes unicellulaires. Il est lié à la membrane grâce à une liaison avec une molécule de dolichol, un lipide isoprénoïde intégré dans la membrane du RE..
Après sa synthèse, l'oligosaccharide est transféré par le complexe enzymatique oligosacryltransférase sur un résidu asparagine inclus dans la séquence tri-peptidique Asn-X-Ser / Thr d'une protéine en cours de traduction.
Les trois résidus Glc à la fin de l'oligosaccharide servent de signal pour une synthèse correcte des oligosaccharides et sont clivés ensemble avec l'un des résidus Man avant que la protéine ne soit transportée dans l'appareil de Golgi pour un traitement ultérieur..
Une fois dans l'appareil de Golgi, les portions d'oligosaccharides attachées aux glycoprotéines peuvent être modifiées par l'addition de galactose, d'acide sialique, de fucose et de nombreux autres résidus, donnant des chaînes d'une variété et d'une complexité beaucoup plus grandes..
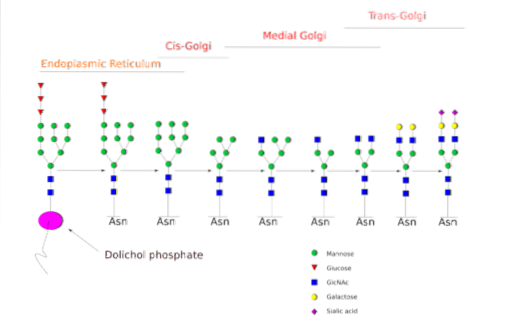
La machinerie enzymatique nécessaire pour effectuer les processus de glycosylation comprend de nombreuses glycosyltransférases pour l'addition de sucres, des glycosidases pour leur élimination et différents transporteurs de sucres nucléotidiques pour la contribution des résidus utilisés comme substrats..
Chez les procaryotes
Les bactéries n'ont pas de systèmes membranaires intracellulaires, de sorte que la formation de l'oligosaccharide initial (de seulement 7 résidus) se produit du côté cytosolique de la membrane plasmique..
Ledit précurseur est synthétisé sur un lipide qui est ensuite transloqué par une flipase ATP-dépendante dans l'espace périplasmique, où se produit la glycosylation..
Une autre différence importante entre la glycosylation eucaryote et procaryote est que l'enzyme oligosaccharide transférase (oligosacaryltransférase) des bactéries peut transférer des résidus de sucre vers des parties libres de protéines déjà repliées, non pas comme elles sont traduites par les ribosomes..
De plus, le motif peptidique reconnu par cette enzyme n'est pas la même séquence tri-peptidique eucaryote..
Caractéristiques
Les N-les oligosaccharides attachés aux glycoprotéines servent à diverses fins. Par exemple, certaines protéines nécessitent cette modification post-traductionnelle pour obtenir le repliement approprié de leur structure..
Pour d'autres, il assure la stabilité, soit en évitant la dégradation protéolytique, soit parce que cette portion leur est nécessaire pour remplir leur fonction biologique..
Les oligosaccharides ayant un fort caractère hydrophile, leur addition covalente à une protéine modifie nécessairement sa polarité et sa solubilité, ce qui peut être pertinent d'un point de vue fonctionnel..
Une fois attachés aux protéines membranaires, les oligosaccharides sont de précieux vecteurs d'information. Ils participent aux processus de signalisation, de communication, de reconnaissance, de migration et d'adhésion cellulaire.
Ils jouent un rôle important dans la coagulation du sang, la guérison et la réponse immunitaire, ainsi que dans le traitement du contrôle de la qualité des protéines, qui est dépendant du glycane et indispensable pour la cellule..
Importance
Au moins 18 maladies génétiques ont été liées à la glycosylation des protéines chez l'homme, dont certaines impliquent un mauvais développement physique et mental, tandis que d'autres peuvent être mortelles..
Il existe un nombre croissant de découvertes liées aux maladies de glycosylation, en particulier chez les patients pédiatriques. Beaucoup de ces troubles sont congénitaux et concernent des défauts associés aux étapes initiales de la formation d'oligosaccharides ou à la régulation des enzymes qui participent à ces processus..
Une grande partie des protéines glycosylées constituant le glycocalyx, il existe un intérêt croissant pour vérifier que les mutations ou altérations des processus de glycosylation peuvent être liées à la modification du microenvironnement des cellules tumorales et favoriser ainsi la progression des tumeurs et le développement de métastases chez les patients cancéreux.
Les références
- Aebi, M. (2013). Glycosylation des protéines N-liées dans l'ER. Biochimica et Biophysica Acta, 1833(11), 2430-2437.
- Dennis, J. W., Granovsky, M. et Warren, C. E. (1999). Glycosylation des protéines dans le développement et la maladie. BioEssays, vingt-et-un(5), 412-421.
- Lodish, H., Berk, A., Kaiser, C. A., Krieger, M., Bretscher, A., Ploegh, H.,… Martin, K. (2003). Biologie cellulaire moléculaire (5e éd.). Freeman, W. H. & Company.
- Luckey, M. (2008). Biologie structurale membranaire: avec des fondements biochimiques et biophysiques. La presse de l'Universite de Cambridge. Récupéré de www.cambrudge.org/9780521856553
- Nelson, D. L. et Cox, M. M. (2009). Principes de biochimie de Lehninger. Éditions Omega (5e éd.).
- Nothaft, H., et Szymanski, C. M. (2010). Glycosylation des protéines chez les bactéries: plus douce que jamais. Nature Reviews Microbiologie, 8(11), 765-778.
- Ohtsubo, K. et Marth, J. D. (2006). Glycosylation dans les mécanismes cellulaires de la santé et de la maladie. Cellule, 126(5), 855-867.
- Spiro, R. G. (2002). Glycosylation des protéines: nature, distribution, formation enzymatique et implications sur la maladie des liaisons glycopeptidiques. Glycobiologie, 12(4), 43R-53R.
- Stowell, S. R., Ju, T., et Cummings, R. D. (2015). Glycosylation des protéines dans le cancer. Examen annuel de la pathologie: mécanismes de la maladie, dix(1), 473-510.
- Strasser, R. (2016). Glycosylation des protéines végétales. Glycobiologie, 26(9), 926-939.
- Xu, C. et Ng, D. T. W. (2015). Contrôle de qualité dirigé par la glycosylation du repliement des protéines. Nature Reviews Biologie cellulaire moléculaire, 16(12), 742-752.
- Zhang, X. et Wang, Y. (2016). Contrôle de la qualité de la glycosylation par la structure de Golgi. Journal de biologie moléculaire, 428(16), 3183-3193.


Personne n'a encore commenté ce post.