
Propriétés des halogénures d'alkyle, préparation, exemples

Les halogénures d'alkyle sont des composés organiques dans lesquels un atome de carbone avec hybridation sp3 est lié de manière covalente à un halogène (F, Cl, Br, I). Dans une autre perspective, il est commode, pour simplifier, de supposer qu'il s'agit d'haloalcanes; ce sont des alcanes pour lesquels certains atomes H ont été remplacés par des atomes d'halogène.
Aussi, comme son nom l'indique, les atomes d'halogène doivent être liés à des groupes alkyle, R, pour être considérés de ce type d'halogénure; bien que, structurellement, ils puissent être substitués ou ramifiés et avoir des cycles aromatiques, et restent toujours un halogénure d'alkyle.
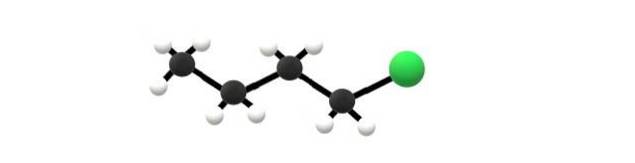
Ci-dessus se trouve la molécule de 1-chlorobutane, qui correspond à l'un des halogénures d'alkyle les plus simples. On peut voir que tous ses carbones ont des liaisons simples, et ont également une hybridation sp3. Par conséquent, la sphère verte, correspondant à l'atome Cl, est liée à un squelette dérivé de l'alcane butane.
Des exemples encore plus simples que le 1-chlorobutane sont ceux dérivés du gaz méthane: le plus petit hydrocarbure de tous.
De sa molécule de CH4 Les atomes H peuvent être remplacés par, disons, de l'iode. Si un H est substitué, nous aurons le CH3I (iodométhane ou iodure de méthyle). En substituant deux H, nous aurons le CHdeuxjedeux (diiodométhane ou iodure de méthylène). Puis et enfin, les I remplacent tous les H en donnant CHI3 (iodoforme) et CI4 (tétraiodure de carbone).
Les halogénures d'alkyle sont caractérisés par le fait qu'ils sont très réactifs et, en ayant les atomes les plus électronégatifs du tableau périodique, on a l'intuition qu'à travers des mécanismes sans fin, ils exercent une influence sur les matrices biologiques..
Index des articles
- 1 Propriétés des halogénures d'alkyle
- 1.1 Points d'ébullition et de fusion
- 1.2 Polarité
- 1.3 Pouvoir solvant
- 2 Nomenclature
- 2.1 Exemple
- 3 Obtention
- 3.1 Halogénation avec lumière ou rayonnement ultraviolet
- 3.2 Ajout d'hydrocides ou d'halogènes aux alcènes
- 4 réactions
- 4.1 Substitution nucléophile
- 4.2 Élimination
- 4.3 Synthèse des réactifs de Grignard
- 5 exemples
- 6 utilisations
- 6.1 Solvant
- 6.2 Synthèse organique
- 6.3 Industrie pharmaceutique
- 6.4 Fluides frigorigènes
- 7 Références
Propriétés des halogénures d'alkyle
Les propriétés de cette famille de composés dépendent de leurs structures moléculaires. Cependant, par rapport à ceux de ses alcanes dérivés, des différences notables peuvent être observées dues au simple fait d'avoir des liaisons C-X (X = atome d'halogène).
Autrement dit, les liaisons C-X sont responsables de toute différence ou similitude entre un ou plusieurs halogénures d'alkyle..
Pour commencer, les liaisons C-H sont presque apolaires, étant donné la petite différence d'électronégativité entre C et H; d'autre part, les liaisons C-X présentent un moment dipolaire permanent, du fait que les halogènes sont plus électronégatifs que le carbone (en particulier le fluor).
Par contre, certains halogènes sont légers (F et Cl), tandis que d'autres sont lourds (Br et I). Leurs masses atomiques façonnent également les différences au sein des liaisons C-X; et à son tour, directement sur les propriétés de l'halogénure.
Par conséquent, ajouter des halogènes à un hydrocarbure équivaut à augmenter sa polarité et sa masse moléculaire; équivaut à le rendre moins volatil (jusqu'à un certain point), moins inflammable et à augmenter ses points d'ébullition ou de fusion.
Points d'ébullition et de fusion
Cela dit, la taille et donc le poids des différents halogènes sont indiqués par ordre croissant:
F < Cl < Br < I
Ainsi, on peut s'attendre à ce que les halogénures d'alkyle contenant des atomes F soient plus légers que ceux contenant des atomes de Br ou I..
Par exemple, certains halogénures dérivés du méthane sont considérés:
CH3F < CH3Cl < CH3Br < CH3je
CHdeuxFdeux < CHdeuxCldeux < CHdeuxBrdeux < CHdeuxjedeux
Et ainsi de suite pour les autres produits dérivés d'un degré d'halogénation plus élevé. Notez que l'ordre est maintenu: les halogénures de fluor sont plus légers que les halogénures d'iode. Non seulement cela, mais aussi leurs points d'ébullition et de fusion obéissent également à cet ordre; RF bout à des températures plus basses que RI (R = CH3, pour ce cas).
De même, tous ces liquides sont incolores, car les électrons ne peuvent pas absorber ou libérer des photons dans leurs liaisons C-X pour transiter par d'autres niveaux d'énergie. Cependant, à mesure qu'ils deviennent plus lourds, ils peuvent cristalliser et afficher des couleurs (tout comme l'iodoforme, CHI3).
Polarité
Les liaisons C-X diffèrent en polarité, mais dans l'ordre inverse comme ci-dessus:
C-F> C-Cl> C-Br> C-I
Par conséquent, les liaisons C-F sont plus polaires que les liaisons C-I. Étant plus polaires, les halogénures RF ont tendance à interagir par le biais de forces dipôle-dipôle. Pendant ce temps, dans les halogénures RBr ou RI, leurs moments dipolaires sont plus faibles et les interactions régies par les forces de dispersion de Londres gagnent en force..
Pouvoir solvant
Comme les halogénures d'alkyle sont plus polaires que les alcanes dont ils sont dérivés, ils augmentent leur capacité à dissoudre un plus grand nombre de composés organiques. C'est pour cette raison qu'ils ont tendance à être de meilleurs solvants; bien que cela ne signifie pas qu'ils peuvent supplanter les alcanes dans toutes les applications.
Il existe des critères techniques, économiques, écologiques et de performance pour préférer un solvant halogéné à un alcane.
Nomenclature
Il existe deux façons de nommer un halogénure d'alkyle: par son nom usuel ou par son nom systématique (IUPAC). Les noms communs sont généralement plus pratiques à utiliser lorsque RX est simple:
CHCl3
Chloroforme: nom usuel
Trichlorure de méthyle ou trichlorométhane: nom IUPAC.
Mais les noms systématiques sont préférables (et la seule option), lorsque vous avez des structures ramifiées. Ironiquement, les noms communs sont à nouveau utiles lorsque les structures sont trop compliquées (comme celles qui seront vues dans la dernière section).
Les règles de dénomination d'un composé selon le système IUPAC sont les mêmes que pour les alcools: la chaîne principale est identifiée, qui est la plus longue ou la plus ramifiée. Ensuite, les carbones sont répertoriés à partir de l'extrémité la plus proche des substituants ou des branches, nommés par ordre alphabétique.
Exemple
Pour l'illustrer, nous avons l'exemple suivant:
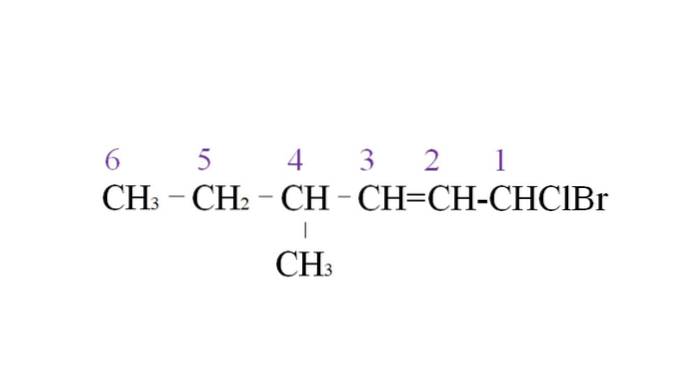
La première branche est le groupe méthyle en C-4; mais, comme il y a une double liaison, elle gagne une priorité plus élevée sur la règle énoncée. Pour cette raison, la plus longue chaîne commence à être répertoriée à partir de la droite, dirigée par un atome de carbone lié à deux halogènes: Cl et Br.
Avec l'énumération, les substituants sont nommés par ordre alphabétique:
1-bromo-1-chloro-4-méthyl-2-hexène.
Obtention
Pour obtenir les halogénures d'alkyle, les molécules doivent être soumises à un procédé d'halogénation; c'est-à-dire incorporer des atomes d'halogène dans leurs structures, en particulier un atome avec un carbone sp3.
Il existe deux méthodes pour les obtenir ou les synthétiser: par rayonnement ultraviolet via un mécanisme radicalaire, ou par ajout d'hydrocides ou d'halogènes..
Halogénation avec lumière ou rayonnement ultraviolet
La première, la moins appropriée et la moins performante, consiste à irradier les alcanes avec un rayonnement ultraviolet (hv) en présence d'un halogène. Par exemple, les équations de la chloration du méthane sont présentées:
CH4 + Cldeux => CH3Cl + HCl (sous lumière UV)
CH3Cl + Cldeux => CHdeuxCldeux + HCl
CHdeuxCldeux + Cldeux => CHCl3 + HCl
CHCl3 + Cldeux => CCl4 + HCl
Les quatre composés (CH3Cl, CHdeuxCldeux, CHCl3 et CCl4) sont formés, et donc vous avez un mélange, qui peut être soumis à une distillation fractionnée. Cependant, cette méthode n'est pas pratique et le recours à des synthèses organiques est préféré..
Un autre exemple est la bromation du n-hexane:
CH3CHdeuxCHdeuxCHdeuxCHdeuxCH3 + Brdeux => CH3(Br) CHCHdeuxCHdeuxCHdeuxCH3 + HBr
Encore une fois, dans cette réaction, la lumière ou le rayonnement ultraviolet est utilisé pour favoriser la formation de radicaux libres. Le brome, comme il s'agit d'un liquide rouge foncé, se décolore au fur et à mesure qu'il réagit, observant ainsi un changement de couleur du rouge à l'incolore lorsque le 2-bromohexane se forme..
Ajout d'hydrocides ou d'halogènes aux alcènes
La deuxième méthode d'obtention des halogénures d'alkyle consiste à traiter des alcools (ROH) ou des alcènes (RdeuxC = CRdeux) avec des hydracides. Les hydracides ont la formule générale HX (HF, HCl, HBr et HI). Un exemple sera montré en utilisant de l'éthanol pour chacun d'eux:
CH3CHdeuxOH + HF => CH3CHdeuxF + HdeuxOU ALORS
CH3CHdeuxOH + HCl => CH3CHdeuxCl + HdeuxOU ALORS
CH3CHdeuxOH + HBr => CH3CHdeuxBr + HdeuxOU ALORS
CH3CHdeuxOH + HI => CH3CHdeuxI + HdeuxOU ALORS
De même, les alcènes peuvent ajouter des molécules HX à leurs doubles liaisons, formant des halogénures d'alkyle secondaires..
CHdeux= CH-CH3 + HBr => BrCHdeux-CHdeux-CH3 + CH3-CHBr-CH3
Le produit BrCHdeux-CHdeux-CH3 est le 1-bromopropane et CH3-CHBr-CH3 2-bromopropane. Le second est le produit majoritaire car il est le plus stable, tandis que le premier est produit dans une moindre mesure car il est plus instable. C'est parce que le CH3CHBrCH3 est un halogénure d'alkyle secondaire.
Très similaire se produit lorsque ce qui est ajouté à l'alcène est une molécule de Xdeux:
CHdeux= CH-CH3 + Brdeux => BrCHdeux-CHBr-CH3
Cependant, un halogénure d'alkyle est obtenu avec deux atomes de brome liés à des carbones adjacents; halogénure d'alkyle vicinal. Si, par contre, vous aviez les deux bromes attachés au même carbone, vous auriez un halogénure d'alkyle géminal, comme celui-ci:
BrdeuxCH-CHdeux-CH3
Réactions
Substitution nucléophile
Les réactivités des halogénures d'alkyle sont basées sur la fragilité ou la résistance de la liaison C-X. Plus l'halogène est lourd, plus la liaison est faible et donc plus elle se cassera facilement. Dans une réaction chimique, les liaisons sont rompues et de nouvelles se forment; Les liaisons C-X sont rompues, pour former une liaison C-G (G = nouveau groupe).
En termes plus appropriés, X agit comme un groupe partant, et G comme un groupe entrant dans une réaction de substitution nucléophile. Pourquoi cette réaction se produit-elle? Parce que X, étant plus électronégatif que le carbone, «vole» la densité électronique, lui laissant un déficit d'électrons qui se traduit par une charge partielle positive:
Cδ+-Xδ-
Si une espèce négative (: G-) ou neutre avec une paire d'électrons disponible (: G), capable de former une liaison C-G plus stable, X finira par être remplacé par G. Ce qui précède peut être représenté par l'équation chimique suivante:
RX +: G- => RG + X-
Plus la liaison C-X ou R-X est faible, plus sa réactivité ou sa tendance à être remplacée par le agent nucléophile (ou nucléophile) G; c'est-à-dire les amateurs de noyaux ou de charges positives.
Exemples
Une série d'équations générales pour les substitutions nucléophiles que les halogénures d'alkyle peuvent subir est présentée ci-dessous:
RX + OH- => ROH + X- (Alcools)
+ OU ALORS'- => ROR' (Ethers, synthèse Williamson)
+ je- => RI (Iodures d'alkyle)
+ CN- => RCN (Nitriles)
+ R'COO- => RCOOR '(Esters)
+ NH3 => RNHdeux (Amines)
+ P (C6H5)3 => RP (C6H5)3+ X- (Sels de phosphonium)
+ SH- => RSH (Thiols)
A partir de ces exemples, on peut déjà soupçonner la valeur des halogénures d'alkyle pour les synthèses organiques. L'une des nombreuses substitutions restantes à citer est celle de la réaction de Friedel Crafts, utilisée pour «déchirer» les cycles aromatiques:
RX + ArH + AlCl3 => ArR
Dans cette réaction, un H du cycle aromatique est remplacé par un groupe R du RX.
Élimination
Les halogénures d'alkyle peuvent libérer des molécules HX par une réaction d'élimination; spécifiquement, une déshydrohalogénation:
RdeuxCH-CXRdeux + Oh- => RdeuxC = CRdeux + HX
On dit que la déshydrohalogénation se produit parce qu'un H et un X sont tous deux perdus dans la même molécule HX.
Synthèse des réactifs de Grignard
Les halogénures d'alkyle peuvent réagir avec certains métaux pour former le réactif de Grignard, utilisé pour ajouter des groupes R à d'autres molécules. L'équation générale de sa synthèse est la suivante:
RX + Mg => RMgX
Exemples
Divers exemples d'halogénures d'alkyle ont déjà été mentionnés tout au long des sections. Quelques autres, simples, sont:
-Chlorure d'éthyle, CH3CHdeuxCl
-Fluorure d'isopropyle, (CH3)deuxCHdeuxF
-2-méthyl-3-chloropentane, CH3-CH (CH3) -CHCl-CHdeuxCH3
-iodure de sec-butyle, CH3CHdeuxCHdeuxI-CH3
-3-bromo-6-iodoheptane, CH3-CHdeux-CHBr-CHdeux-CHdeux-CHdeuxje
-3,4-dibromo-1-pentène, CH3-CHBr-CHBr-CH = CHdeux
Applications
Solvant
Dans les sections précédentes, on a mentionné la capacité de solvant des halogénures d'alkyle. L'industrie a profité de cette propriété pour les utiliser comme nettoyants, que ce soit pour les matières textiles, les composants électroniques, ou pour éliminer les taches de vernis..
De même, ils sont utilisés comme solvants pour les peintures, ou comme échantillons organiques ou graisseux pour d'innombrables types de tests analytiques..
Synthèse organique
Les halogénures d'alkyle sont très utiles pour "alkyler" les cycles aromatiques, tout en servant de source de départ pour la synthèse de pratiquement toutes les autres familles de composés organiques. Synthétiquement, RX est considéré comme une source de groupes ou de chaînes R, ce qui peut être souhaité pour une incorporation dans des composés hautement aromatiques..
Industrie pharmaceutique
Il a été mentionné au début que les atomes d'halogène interagissent avec les matrices biologiques, de sorte que dans nos organismes ils ne peuvent pas passer inaperçus sans générer un changement, positif ou négatif. Si un médicament exerce un effet positif sur le corps, ayant un atome d'halogène, cet effet peut ou non être augmenté.
Donc, si X est directement lié à un carbone hybride sp3, il aura un halogénure d'alkyle et non un dérivé halogéné. Certains de ces halogénures sont présentés ci-dessous dans la série d'images suivante:
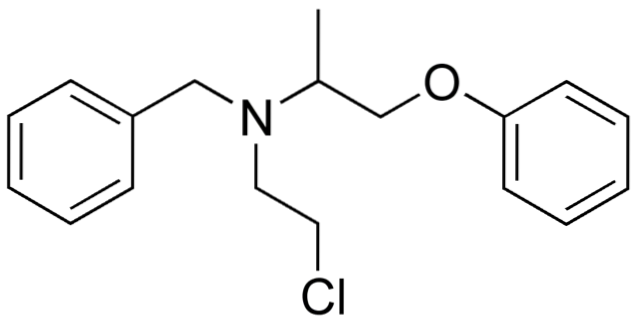
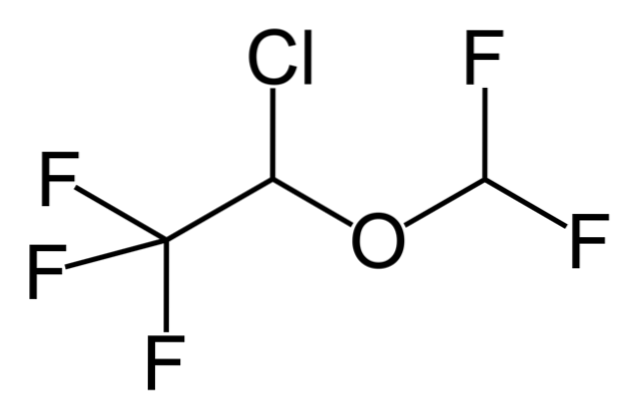

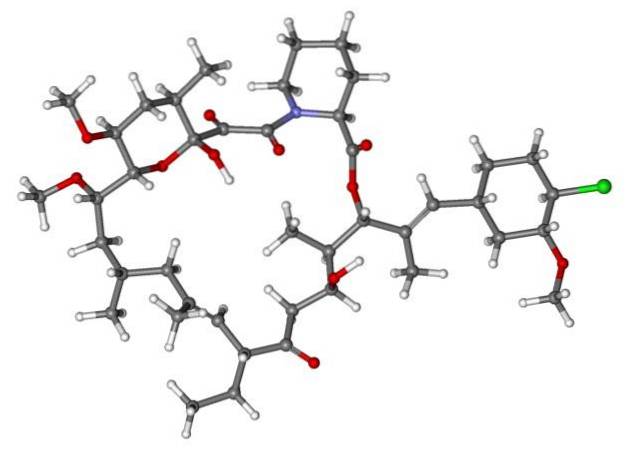

Notez que dans ces cinq médicaments, il y a au moins une liaison de type CHdeux-X ou CH-X; c'est-à-dire que l'halogène est attaché à un carbone sp3.
Frigorigènes
Le fameux réfrigérant Fréon-12 (CHCIFdeux), comme d'autres fluoroalcanes ou hydrofluorocarbures, ont remplacé les gaz ammoniac et les chlorofluorocarbures (CFC) dans cette fonction car, bien qu'ils soient des substances non volatiles ou toxiques, ils détruisent la couche d'ozone; tandis que le fréon-12, étant plus réactif, est détruit avant d'atteindre de telles altitudes.
Les références
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Clark Jim. (2016, 14 juillet). Utilisations des halogénures d'alkyle. Chimie LibreTexts. Récupéré de: chem.libretexts.org
- Gál, B., Bucher, C. et Burns, N. Z. (2016). Halogénures d'alkyle chiraux: motifs sous-explorés en médecine. Drogues marines, 14 (11), 206. doi: 10.3390 / md14110206
- Halogénures d'alkyle. Récupéré de: chemed.chem.purdue.edu
- Patkar Prachi. (16 juillet 2017). Tout sur les halogénures d'alkyle: propriétés, utilisations et bien plus encore. Science frappée. Récupéré de: sciencestruck.com
- R. Navire. (2016). Halogénures d'alkyle. Récupéré de: hyperphysics.phy-astr.gsu.edu
- Guide d'apprentissage pour le chapitre 9 - Halogénures d'alkyle I. Récupéré de: cactus.dixie.edu
- Q.A. Eduardo Vega Barrios. (s.f.). Halogénures d'alkyle: propriétés, utilisations et applications. [PDF. Récupéré de: cvonline.uaeh.edu.mx



Personne n'a encore commenté ce post.