
Propriétés physiques et chimiques de l'hexane (C6H14), structure, utilisations, toxicité
le hexane est un hydrocarbure caractérisé en ce qu'il est un composé organique dont la formule chimique condensée est C6H14. C'est un liquide incolore et transparent qui ne peut pas être mélangé avec de l'eau. Il a cinq isomères, le linéaire étant l'un des hydrocarbures paraffiniques les plus importants dans l'industrie et la recherche.
L'hexane est obtenu par distillation fractionnée du pétrole brut. De même, il est naturellement présent dans les agrumes et dans les fractions volatiles de diverses plantes ou fruits comme la pomme, la goyave, les noisettes grillées, la patate douce et la sauge..
C'est un liquide volatil hautement inflammable présent dans l'essence, les colles à séchage rapide et le ciment de caoutchouc. L'hexane est utilisé comme solvant dans le processus d'extraction des huiles végétales, ainsi que des lipides et des graisses présents dans l'eau et les sols contaminés.
Les personnes professionnellement exposées à l'hexane peuvent subir des lésions du système nerveux périphérique, se manifestant par des picotements et des crampes dans les jambes et les bras; en plus d'une faiblesse musculaire généralisée et, dans les cas graves, d'une atrophie du muscle squelettique.
Index des articles
- 1 Propriétés physiques et chimiques des hexanes
- 1.1 Apparence physique
- 1.2 Masse molaire
- 1.3 Odeur
- 1.4 Seuil olfactif
- 1.5 Densité
- 1.6 Point de fusion
- 1.7 Point d'ébullition
- 1.8 Point d'éclair
- 1.9 Solubilité dans l'eau
- 1.10 Solubilité dans les solvants
- 1.11 Densité de vapeur relative avec l'air
- 1.12 Coefficient de partage octanol / eau
- 1.13 Pression de vapeur
- 1.14 Longueur d'onde de la densité optique maximale
- 1.15 Indice de réfraction
- 1.16 Viscosité
- 1.17 Capacité calorique
- 1.18 Chaleur de combustion
- 1.19 Chaleur de vaporisation
- 1.20 Tension superficielle
- 1.21 Potentiel d'ionisation
- 1.22 Stabilité
- 1.23 Réactivité
- 2 Structure de l'hexane
- 2.1 Interactions intermoléculaires
- 2.2 Isomères
- 3 utilisations
- 4 Toxicité
- 4.1 Inhalation et contact
- 4.2 Dose sûre
- 5 Références
Propriétés physiques et chimiques des hexanes
Apparence physique
Liquide incolore, transparent et hautement volatil.
Masse molaire
86,178 g / mol
Odeur
Similaire à l'essence
Seuil d'odeur
1,5 ppm
Densité
0,6606 g / mL
Point de fusion
-96 à -94 ºC
Point d'ébullition
68,5 à 69,1 ºC
point d'allumage
-22 ºC (tasse fermée).
Solubilité dans l'eau
9,5 mg / L (pratiquement non miscible à l'eau)
Solubilité dans les solvants
Très soluble dans l'éthanol, soluble dans l'éther éthylique et le chloroforme. Miscible avec l'alcool, le chloroforme et l'éther.
Densité de vapeur relative avec l'air
2,97 (air = 1)
Coefficient de partage octanol / eau
Log P = 3764
La pression de vapeur
17,60 kPa à 20 ºC
Longueur d'onde de la densité optique maximale
200 nm
Indice de réfraction
1 375
Viscosité
0,3 mPa s
Capacité calorique
265.2 JK-1Taupe-1
Chaleur de combustion
4 163,2 kJ mol-1
Chaleur de vaporisation
31,56 kJ mol-1
Tension superficielle
17,89 mN / m à 25 ºC
Potentiel d'ionisation
10,18 eV
Stabilité
Stable. Incompatible avec les agents oxydants, le chlore, le fluor, le perchlorate de magnésium. Forme un mélange explosif avec l'air.
Réactivité
L'hexane peut réagir vigoureusement avec les matières oxydantes, qui peuvent inclure le chlore liquide, l'oxygène concentré, l'hypochlorite de sodium et l'hypochlorite de calcium. Il est également incompatible avec le tétroxyde de diazote. L'hexane peut attaquer certaines formes de plastiques, de caoutchouc et de revêtements.
Structure de l'hexane
Interactions intermoléculaires
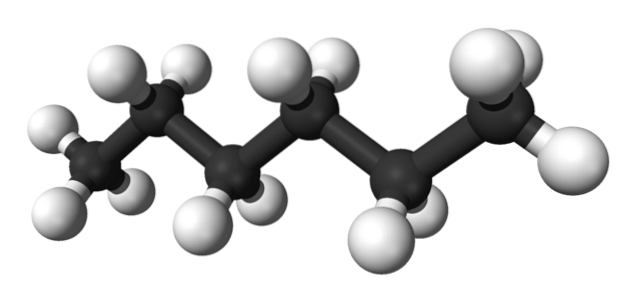
La première image montre la molécule de n-hexane représenté par un modèle à bille et bâton. Les sphères noires correspondent aux atomes de carbone, constituant le squelette carboné en zigzag, tandis que les sphères blanches sont les atomes d'hydrogène. le n-L'hexane est donc un hydrocarbure, linéaire et hautement dynamique.
Parce que toutes ses liaisons C-H sont de faible polarité, la molécule n'a pas de moment dipolaire. Ce faisant, leurs interactions intermoléculaires ne sont pas de type dipôle-dipôle, mais dépendent exclusivement de la masse moléculaire et des forces de dispersion de Londres..
Chaque molécule de n-L'hexane "s'adapte" les uns sur les autres à des températures très basses, comme on le supposerait dans sa structure cristalline. D'autre part, dans le liquide, leurs squelettes fléchissent et font tourner leurs liaisons C-H, ce qui fait que ledit liquide est volatil et bouillonne à 68,7 ° C..
Isomères
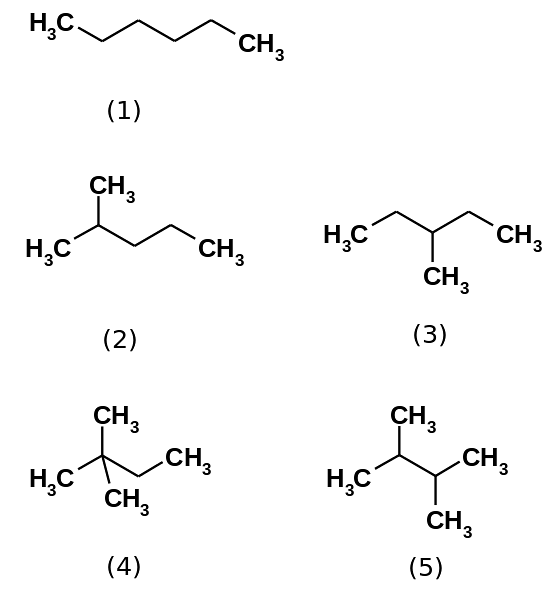
L'hexane hydrocarboné se compose en fait de cinq isomères, étant le n-hexane le moins ramifié, (1). Les quatre autres isomères sont, par ordre croissant:
2-méthylpropane (2)
3-méthylpropane (3)
2,2-diméthylbutane (4)
2,3-diméthylbutane (5)
Notez également que les structures deviennent plus ramifiées de (1) à (5). Étant plus ramifiées, les forces de dispersion diminuent, car il n'y a plus de portions linéaires qui se coincent efficacement. Ceci conduit à une diminution et une variation des points d'ébullition des isomères; bien que certains écarts acceptables soient observés.
Le 2-méthylpropane (bp = 60,3 ° C) et le 3-méthylpropane (bp = 63,3 ° C) sont également ramifiés, mais leurs points d'ébullition sont différents. Ensuite, il est suivi du 2,3-diméthylbutane (peb = 58 ºC), pour enfin localiser le 2,2-diméthylbutane comme le liquide le plus volatil (peb = 49,7 ºC).
Applications
L'hexane est mélangé avec des produits chimiques similaires pour produire des solvants. Parmi les noms donnés à ces solvants, on trouve l'hexane commercial, les hexanes mixtes, etc. Ils sont utilisés comme agents de nettoyage dans les industries du textile, de l'ameublement et de l'héliogravure..
L'hexane est un ingrédient des colles utilisées dans l'imperméabilisation des toits, les chaussures et le cuir. Il est également utilisé pour la reliure de livres, pour le moulage de pilules et de comprimés, la mise en conserve, la fabrication de pneus et de balles de baseball..
L'hexane est utilisé dans la détermination de l'indice de réfraction des minéraux et du liquide de remplissage pour les thermomètres au lieu du mercure; généralement avec une teinte rouge ou bleue. Il est également utilisé dans l'extraction des graisses et des huiles de l'eau pour l'analyse de ses contaminants..
L'hexane est utilisé comme solvant dans l'extraction de l'huile de graines végétales, telles que le soja, le canola ou la mûre. De plus, il est utilisé pour dégraisser des pièces d'origines différentes. Il est utilisé dans la dénaturation de l'alcool, dans la méthode d'analyse HPLC et en spectrophotométrie.
Toxicité
Inhalation et contact
La toxicité aiguë de l'hexane est relativement faible, bien qu'il s'agisse d'un anesthésique léger. Une exposition aiguë à des concentrations élevées d'hexane peut produire, par inhalation, une légère dépression du système nerveux central (SNC), se manifestant par des étourdissements, des vertiges, des nausées légères et des maux de tête..
Il peut également provoquer une dermatite et une irritation des yeux et de la gorge. L'inhalation chronique d'hexane, liée à l'activité professionnelle, peut endommager le système nerveux périphérique (polyneuropathie sensorimotrice).
Les premiers symptômes sont des picotements et des crampes dans les jambes et les bras, suivis d'une faiblesse musculaire. Dans les cas graves, une atrophie du muscle squelettique peut survenir, ainsi qu'une perte de coordination et des problèmes de vision.
La toxicité de l'hexane est liée à la génération du métabolite hexane-2,5-dione. Il réagit avec l'acide aminé lysine d'une chaîne latérale protéique, provoquant la perte de la fonction protéique..
Dose sûre
L'Agence de protection de l'environnement (EPA) a calculé une concentration de référence (RfC) pour l'hexane de 0,2 mg / m3, et une dose de référence (RfD) de 0,06 mg / kg de poids corporel / jour.
Dans les années 60 et 70, un groupe de travailleurs de l'industrie de la chaussure au Japon présentait des troubles nerveux. La cause était qu'ils respiraient dans une atmosphère d'hexane de 500 à 2500 ppm, pendant 8 à 14 heures par jour.
Les travailleurs ont présenté les symptômes connus de l'inhalation chronique d'hexane, découvrant aux médecins que les nerfs qui contrôlaient les muscles des bras et des jambes étaient endommagés..
Les références
- Danielle Reid. (2019). Hexane: structure, formule et propriétés. Étude. Récupéré de: study.com
- Centre national d'information sur la biotechnologie. (2019). Hexane. Base de données PubChem. CID = 8058. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Wikipédia. (2019). Hexane. Récupéré de: en.wikipedia.org
- Monde des molécules. (s.f.). Molécule d'hexane. Récupéré de: worldofmolecules.com
- Livre chimique. (2017). Hexane. Récupéré de: Chemicalbook.com
- Le Commonwealth d'Australie. (s.f.). n-hexane: sources d'émissions. Récupéré de: npi.gov.au
- EPA. (2000). Hexane. [PDF]. Récupéré de: epa.gov
- Agence pour le registre des substances toxiques et des maladies. (1999). Déclaration de santé publique pour le n-hexane. Récupéré de: atsdr.cdc.gov


Personne n'a encore commenté ce post.