
Propriétés et exemples des hydrocarbures insaturés

Les hydrocarbures insaturés sont ceux qui contiennent au moins une double liaison carbone dans leur structure, pouvant contenir une triple liaison puisque la saturation d'une chaîne signifie qu'elle a reçu tous les atomes d'hydrogène possibles dans chaque carbone, et qu'il n'y a pas de paires d'électrons libres où plus d'hydrogènes peuvent entrer.
Les hydrocarbures insaturés sont divisés en deux types: les alcènes et les alcynes. Les alcènes sont des composés hydrocarbonés qui ont une ou plusieurs doubles liaisons au sein de leur molécule. Pendant ce temps, les alcynes sont des composés hydrocarbonés qui ont une ou plusieurs triples liaisons dans leur formule..
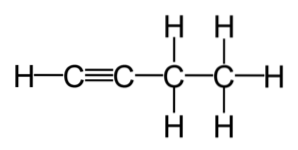
Les alcènes et les alcynes sont fréquemment utilisés dans le commerce. Ce sont des composés avec un niveau de réactivité plus élevé que celui des hydrocarbures saturés, ce qui en fait le point de départ de nombreuses réactions, générées à partir des alcènes et alcynes les plus courants..
Index des articles
- 1 Nomenclature
- 1.1 Nomenclature des alcènes
- 1.2 Nomenclature des alcynes
- 2 propriétés
- 2.1 Liaisons doubles et triples
- 2.2 Isomérisation cis-trans
- 2.3 Acidité
- 2.4 Polarité
- 2.5 Points d'ébullition et de fusion
- 3 exemples
- 3.1 Éthylène (C2H4)
- 3.2 Éthine (C2H2)
- 3.3 Propylène (C3H6)
- 3.4 Cyclopentène (C5H8)
- 4 Articles d'intérêt
- 5 Références
Nomenclature
Les hydrocarbures insaturés sont nommés différemment selon qu'il s'agit d'alcènes ou d'alcynes, en utilisant les suffixes "-eno" et "-ino".
Les alcènes ont au moins une double liaison carbone-carbone dans leur structure et ont la formule générale CnH2n, tandis que les alcynes contiennent au moins une triple liaison et sont traités par la formule CnH2n-2.
Nomenclature des alcènes
Pour nommer les alcènes, les positions des doubles liaisons carbone-carbone doivent être indiquées. Les noms des composés chimiques contenant des liaisons C = C se terminent par le suffixe «-eno».
Comme pour les alcanes, le nom du composé de base est déterminé par le nombre d'atomes de carbone dans la chaîne la plus longue. Par exemple, la molécule CHdeux= CH-CHdeux-CH3 sera appelé "1-butène", mais celui de H3C-CH = CH-CH3 s'appellera "2-butène".
Les nombres observés dans les noms de ces composés indiquent l'atome de carbone avec le plus petit nombre dans la chaîne dans laquelle se trouve la liaison C = C de l'alcène..
Le nombre de carbones dans cette chaîne identifie le préfixe du nom, similaire aux alcanes ("met-", "et-", "pro-", "but-", etc.), mais en utilisant toujours le suffixe "-eno ".
Il faut également préciser si la molécule est cis ou trans, qui sont des types d'isomères géométriques. Ceci est ajouté dans le nom, tel que 3-éthyl-cis-2-heptane ou 3-éthyl-trans-2-heptane.
Nomenclature des alcynes
Pour deviner les noms des composés chimiques contenant des liaisons triples C≡C, le nom du composé est déterminé par le nombre d'atomes C dans la chaîne la plus longue.
Semblable au cas des alcènes, les noms des alcynes indiquent la position dans laquelle se trouve la triple liaison carbone-carbone; par exemple, dans les cas de HC≡C-CHdeux-CH3, ou "1-butyne", et H3C-C≡C-CH3, ou "2-butyne".
Propriétés
Les hydrocarbures insaturés comprennent un nombre énorme de molécules différentes, c'est pourquoi ils présentent une série de caractéristiques qui les définissent, qui sont identifiées ci-dessous:
Liaisons doubles et triples
Les doubles et triples liaisons des alcènes et des alcynes ont des caractéristiques spéciales qui les différencient des liaisons simples: une simple liaison représente la plus faible des trois, étant formée par une liaison sigma entre deux molécules.
La double liaison est formée par une liaison sigma et un pi, et la triple liaison par une liaison sigma et deux pi. Cela rend les alcènes et alcynes plus forts et nécessite plus d'énergie pour se décomposer lorsque des réactions se produisent..
De plus, les angles de liaison formés dans une double liaison sont de 120 °, tandis que ceux de la triple liaison sont de 180 °. Cela signifie que les molécules à triple liaison ont un angle linéaire entre ces deux carbones..
Isomérisation cis-trans
Dans les alcènes et autres composés à doubles liaisons, une isomérisation géométrique se produit, qui diffère du côté des liaisons dans lesquelles se trouvent les groupes fonctionnels attachés aux carbones impliqués dans cette double liaison..
Lorsque les groupes fonctionnels d'un alcène sont orientés dans le même sens par rapport à la double liaison, cette molécule est appelée cis, mais lorsque les substituants sont dans des directions différentes, on l'appelle trans.
Cette isomérisation n'est pas une simple différence de localisation; Les composés peuvent varier considérablement simplement parce qu'ils sont à géométrie cis ou à géométrie trans.
Les composés Cis impliquent généralement des forces dipôle-dipôle (qui ont une valeur nette de zéro en trans); De plus, ils ont une polarité, des points d'ébullition et de fusion plus élevés et sont d'une densité plus élevée que leurs homologues trans. De plus, les composés trans sont plus stables et dégagent moins de chaleur de combustion..
Acidité
Les alcènes et les alcynes ont une acidité plus élevée que les alcanes, en raison de la polarité de leurs doubles et triples liaisons. Ils sont moins acides que les alcools et les acides carboxyliques; et des deux, les alcynes sont plus acides que les alcènes.
Polarité
La polarité des alcènes et des alcynes est faible, encore plus dans les composés transalcènes, ce qui rend ces composés insolubles dans l'eau..
Pourtant, les hydrocarbures insaturés se dissolvent facilement dans les solvants organiques courants tels que les éthers, le benzène, le tétrachlorure de carbone et d'autres composés à polarité faible ou nulle..
Points d'ébullition et de fusion
En raison de leur faible polarité, les points d'ébullition et de fusion des hydrocarbures insaturés sont faibles, presque équivalents à ceux des alcanes qui ont la même structure carbonée..
Même ainsi, les alcènes ont des points d'ébullition et de fusion inférieurs à ceux des alcanes correspondants, pouvant diminuer encore plus s'ils sont isomères cis, comme indiqué précédemment..
En revanche, les alcynes ont des points d'ébullition et de fusion plus élevés que les alcanes et les alcènes correspondants, bien que la différence ne soit que de quelques degrés..
Enfin, les cycloalcènes ont également des températures de fusion plus faibles que les cycloalcanes correspondants, en raison de la rigidité de la double liaison..
Exemples
Éthylène (CdeuxH4)
Un composé chimique puissant grâce à sa capacité de polymérisation, d'oxydation et d'halogénation, entre autres caractéristiques.
Ethyne (CdeuxHdeux)
Aussi appelé acétylène, c'est un gaz inflammable qui est utilisé comme source utile d'éclairage et de chaleur..
Propylène (C3H6)
Deuxième composé le plus utilisé dans l'industrie chimique au monde, c'est l'un des produits de la thermolyse du pétrole.
Cyclopentène (C5H8)
Un composé du type cycloalcène. Cette substance est utilisée comme monomère pour la synthèse des plastiques.
Articles d'intérêt
Hydrocarbures saturés ou alcanes.
Les références
- Chang, R. (2007). Chimie, neuvième édition. Mexique: McGraw-Hill.
- Wikipédia. (s.f.). Alcènes. Récupéré de en.wikipedia.org
- Boudreaux, K. A. (s.f.). Hydrocarbures insaturés. Récupéré de angelo.edu
- Tuckerman, M. E. (s.f.). Alcènes et Alcynes. Récupéré de nyu.edu
- Université, L. T. (s.f.). Les hydrocarbures insaturés: alcènes et alcynes. Récupéré de chem.latech.edu



Personne n'a encore commenté ce post.