
Structure, propriétés et utilisations de l'hydroxyde d'ammonium
le l'hydroxyde d'ammonium est un composé de formule moléculaire NH4Oh oh5NO produit par la dissolution du gaz ammoniac (NH3) dans l'eau. Pour cette raison, on l'appelle eau ammoniacale ou ammoniaque liquide..
C'est un liquide incolore avec une odeur très intense et forte, qui n'est pas isolable. Ces caractéristiques ont une relation directe avec la concentration de NH3 dissous dans l'eau; concentration qui en fait, étant un gaz, peut en englober d'énormes quantités dissoutes dans un petit volume d'eau.
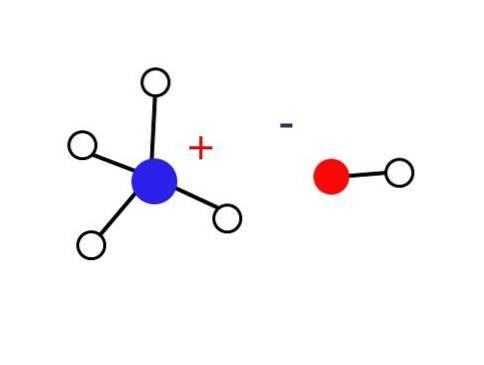
Une très petite partie de ces solutions aqueuses est composée de cations NH.4+ et les anions OH-. En revanche, dans des solutions très diluées ou dans des solides congelés à très basse température, l'ammoniac peut se trouver sous forme d'hydrates, tels que: NH3∙ HdeuxOu, 2NH3∙ HdeuxO et NH3∙ 2HdeuxOU ALORS.
Curieusement, les nuages de Jupiter sont constitués de solutions diluées d'hydroxyde d'ammonium. Cependant, la sonde spatiale Galileo n'a pas réussi à trouver de l'eau dans les nuages de la planète, ce qui serait attendu en raison de la connaissance que nous avons de la formation d'hydroxyde d'ammonium; c'est-à-dire que ce sont des cristaux NH4OH totalement anhydre.
L'ion ammonium (NH4+) est produit dans la lumière tubulaire rénale par l'union de l'ammoniac et de l'hydrogène, sécrété par les cellules tubulaires rénales. De même, l'ammoniac est produit dans les cellules tubulaires rénales lors du processus de transformation de la glutamine en glutamate et, à son tour, lors de la conversion du glutamate en α-cétoglutarate.
L'ammoniac est produit industriellement par la méthode Haber-Bosch, dans laquelle l'azote et l'hydrogène gazeux réagissent; utilisant l'ion ferrique, l'oxyde d'aluminium et l'oxyde de potassium comme catalyseurs. La réaction est effectuée à des pressions élevées (150 à 300 atmosphères) et à des températures élevées (400 à 500 ºC), avec un rendement de 10 à 20%.
L'ammoniac est produit dans la réaction qui, lorsqu'elle s'oxyde, produit des nitrites et des nitrates. Ceux-ci sont essentiels pour obtenir de l'acide nitrique et des engrais tels que le nitrate d'ammonium..
Index des articles
- 1 Structure chimique
- 1.1 Glace ammoniacale
- 2 Propriétés physiques et chimiques
- 2.1 Formule moléculaire
- 2.2 Poids moléculaire
- 2.3 Apparence
- 2.4 Concentration
- 2.5 Odeur
- 2.6 Saveur
- 2.7 Valeur seuil
- 2.8 Point d'ébullition
- 2.9 Solubilité
- 2.10 Solubilité dans l'eau
- 2.11 Densité
- 2.12 Densité de vapeur
- 2.13 Pression de vapeur
- 2.14 Action corrosive
- 2,15 pH
- 2.16 Constante de dissociation
- 3 Nomenclature
- 4 Solubilité
- 5 risques
- 5.1 Réactivité
- 6 utilisations
- 6.1 Dans les aliments
- 6.2 Thérapeutique
- 6.3 Industriel et divers
- 6.4 Dans l'agriculture
- 7 Références
Structure chimique
Comme sa définition l'indique, l'hydroxyde d'ammonium consiste en une solution aqueuse d'ammoniac gazeux. Par conséquent, dans le liquide, il n'y a pas de structure définie autre que celle d'un arrangement aléatoire d'ions NH.4+ et OH- solvaté par les molécules d'eau.
Les ions ammonium et hydroxyle sont les produits d'un équilibre d'hydrolyse de l'ammoniac, il est donc courant que ces solutions aient une odeur piquante:
NH3(g) + HdeuxO (l) <=> NH4+(ac) + OH-(ac)
Selon l'équation chimique, une forte diminution de la concentration en eau déplacerait l'équilibre vers la formation de plus d'ammoniac; c'est-à-dire que lorsque l'hydroxyde d'ammonium est chauffé, des vapeurs d'ammoniac seront libérées.
Pour cette raison, les ions NH4+ et OH- ne parviennent pas à former un cristal dans des conditions terrestres, ce qui se traduit par la base solide NH4Oh n'existe pas.
Ledit solide doit être composé uniquement d'ions interagissant électrostatiquement (comme indiqué sur l'image).
Glace ammoniacale
Cependant, sous des températures bien inférieures à 0 ° C, et entouré d'énormes pressions, comme celles qui règnent dans les noyaux des lunes glacées, l'ammoniac et le gel de l'eau. Ce faisant, ils cristallisent en un mélange solide avec différents rapports stoechiométriques, le plus simple étant NH3∙ HdeuxO: monohydrate d'ammoniaque.
NH3∙ HdeuxO et NH3∙ 2HdeuxOu ce sont de la glace ammoniacale, puisque le solide est constitué d'un arrangement cristallin de molécules d'eau et d'ammoniac liées par des liaisons hydrogène..
Compte tenu d'un changement de T et P, selon des études de calcul qui simulent toutes les variables physiques et leurs effets sur ces glaces, une transition d'une phase NH se produit.3∙ nHdeuxOu à une phase NH4Oh.
Par conséquent, ce n'est que dans ces conditions extrêmes que NH4OH peut exister en tant que produit d'une protonation dans la glace entre NH3 et le HdeuxOU ALORS:
NH3(s) + HdeuxToi) <=> NH4Oh s)
A noter que cette fois, contrairement à l'hydrolyse de l'ammoniac, les espèces impliquées sont en phase solide. Une glace à l'ammoniaque qui devient salée sans dégagement d'ammoniac.
Proprietes physiques et chimiques
Formule moléculaire
NH4Oh oh5NE PAS
Poids moléculaire
35,046 g / mol
Apparence
C'est un liquide incolore.
Concentration
Jusqu'à environ 30% (pour les ions NH4+ et OH-).
Odeur
Très fort et tranchant.
Goût
Acre.
Valeur de seuil
34 ppm pour une détection non spécifique.
Point d'ébullition
38 ºC (25%).
Solubilité
Existe uniquement en solution aqueuse.
Solubilité dans l'eau
Miscible dans des proportions illimitées.
Densité
0,90 g / cm3 à 25 ºC.
Densité de vapeur
Par rapport à l'air pris comme unité: 0,6. Autrement dit, il est moins dense que l'air. Cependant, logiquement, la valeur rapportée fait référence à l'ammoniac en tant que gaz, et non à ses solutions aqueuses ou NH4Oh.
La pression de vapeur
2.160 mmHg à 25 ºC.
Action corrosive
Il est capable de dissoudre le zinc et le cuivre.
pH
11,6 (solution 1N); 11,1 (solution 0,1 N) et 10,6 (solution 0,01 N).
Constante de dissociation
pKb = 4,767; Ko = 1,71 x 10-5 à 20 ºC
pKb = 4,751; Ko = 1 774 x 10-5 à 25ºC.
L'augmentation de la température augmente presque imperceptiblement la basicité de l'hydroxyde d'ammonium.
Nomenclature
Quels sont tous les noms courants et officiels que NH reçoit?4OH? Selon ce qui est établi par l'IUPAC, son nom est l'hydroxyde d'ammonium car il contient l'anion hydroxyle.
L'ammonium, en raison de sa charge +1, est monovalent, donc en utilisant la nomenclature Stock, il est nommé comme: hydroxyde d'ammonium (I).
Bien que l'utilisation du terme hydroxyde d'ammonium soit techniquement incorrecte, puisque le composé n'est pas isolable (du moins pas sur Terre, comme expliqué en détail dans la première section).
En outre, l'hydroxyde d'ammonium est appelé eau ammoniacale et ammoniaque liquide..
Solubilité
NH4L'OH n'existe pas sous forme de sel dans les conditions terrestres, il ne peut pas être estimé à quel point il est soluble dans différents solvants.
Cependant, on s'attend à ce qu'il soit extrêmement soluble dans l'eau, car sa dissolution libérerait d'énormes quantités de NH3. Théoriquement, ce serait un moyen incroyable de stocker et de transporter l'ammoniac.
Dans d'autres solvants capables d'accepter des liaisons hydrogène, tels que les alcools et les amines, on pourrait s'attendre à ce qu'il y soit également très soluble. Ici le cation NH4+ est un donneur de liaison hydrogène, et OH- agit comme les deux.
Des exemples de ces interactions avec le méthanol seraient: H3N+-H - OHCH3 et HO- - HOCH3 (OHCH3 indique que l'oxygène reçoit la liaison hydrogène, pas que le groupe méthyle est lié au H).
Des risques
-Au contact des yeux, il provoque une irritation pouvant entraîner des lésions oculaires..
-C'est corrosif. Par conséquent, au contact de la peau, il peut provoquer une irritation et à des concentrations élevées de réactif, il provoque des brûlures cutanées. Le contact répété de l'hydroxyde d'ammonium avec la peau peut provoquer une sécheresse, des démangeaisons et une rougeur (dermatite)..
-L'inhalation de brouillard d'hydroxyde d'ammonium peut provoquer une irritation aiguë des voies respiratoires, caractérisée par une suffocation, une toux ou un essoufflement. Une exposition prolongée ou répétée à la substance peut entraîner des infections bronchiques récurrentes. De plus, l'inhalation d'hydroxyde d'ammonium peut provoquer une irritation des poumons..
-L'exposition à des concentrations élevées d'hydroxyde d'ammonium peut constituer une urgence médicale car une accumulation de liquide dans les poumons (œdème pulmonaire) peut survenir..
-La concentration de 25 ppm a été prise comme limite d'exposition, dans un quart de travail de 8 heures, dans un environnement où le travailleur est exposé à l'action nocive de l'hydroxyde d'ammonium.
Réactivité
-Outre les effets nocifs potentiels pour la santé d'une exposition à l'hydroxyde d'ammonium, d'autres précautions doivent être prises en compte lors de l'utilisation de la substance..
-L'hydroxyde d'ammonium peut réagir avec de nombreux métaux, tels que: l'argent, le cuivre, le plomb et le zinc. Il réagit également avec les sels de ces métaux pour former des composés explosifs et libérer de l'hydrogène gazeux; qui à son tour, est inflammable et explosif.
-Il peut réagir violemment avec des acides forts, par exemple: l'acide chlorhydrique, l'acide sulfurique et l'acide nitrique. Il réagit également de la même manière avec le sulfate de diméthyle et les halogènes..
-Réagit avec les bases fortes, telles que l'hydroxyde de sodium et l'hydroxyde de potassium, produisant du gaz ammoniac. Ceci peut être vérifié en observant l'équilibre en solution, dans lequel l'ajout d'ions OH- déplace l'équilibre vers la formation de NH3.
-Les métaux de cuivre et d'aluminium, ainsi que d'autres métaux galvanisés, ne doivent pas être utilisés lors de la manipulation d'hydroxyde d'ammonium, en raison de son action corrosive sur eux..
Applications
Dans la nourriture
-Il est utilisé comme additif dans de nombreux aliments dans lesquels il agit comme un agent levant, un contrôle du pH et un agent de finition pour la surface des aliments..
-La liste des aliments dans lesquels l'hydroxyde d'ammonium est utilisé est longue et comprend les produits de boulangerie, les fromages, les chocolats, les bonbons et les puddings..
-L'hydroxyde d'ammonium est répertorié comme une substance sûre par la FDA pour la transformation des aliments, à condition que les normes établies soient respectées..
-Dans les produits à base de viande, il est utilisé comme agent antimicrobien, capable d'éliminer des bactéries telles que E. coli, en le réduisant à des niveaux indétectables. Les bactéries se trouvent dans les intestins des bovins, s'adaptant à l'environnement acide. L'hydroxyde d'ammonium, en régulant le pH, empêche la croissance bactérienne.
Thérapeutique
-L'hydroxyde d'ammonium a plusieurs utilisations thérapeutiques, notamment:
-La solution à 10% est utilisée comme stimulant du réflexe respiratoire
-En externe, il est utilisé sur la peau pour traiter les piqûres et les piqûres d'insectes -Il agit dans le système digestif comme un antiacide et un carminatif, c'est-à-dire qu'il aide à éliminer les gaz.
De plus, il est utilisé comme rubéfiant topique pour les douleurs musculo-squelettiques aiguës et chroniques. En raison de l'action rubéfiante de l'hydroxyde d'ammonium, il y a une augmentation locale du flux sanguin, des rougeurs et des irritations..
Industriel et divers
-Il agit pour réduire les NOx (gaz hautement réactifs tels que l'oxyde nitrique (NO) et le dioxyde d'azote (NOdeux)) pour les émissions de batterie et la réduction de NOx dans les émissions de cheminée.
-Il est utilisé comme plastifiant; additif de peinture et pour le traitement de surface.
-Augmente la porosité des cheveux permettant aux pigments du colorant d'avoir une plus grande pénétration, ce qui permet une meilleure finition.
-L'hydroxyde d'ammonium est utilisé comme agent antimicrobien dans le traitement des eaux usées. De plus, il est impliqué dans la synthèse de la chloramine. Cette substance remplit une fonction similaire au chlore dans la purification de l'eau de piscine, ayant l'avantage d'être moins toxique.
-Il est utilisé comme inhibiteur de corrosion dans le processus de raffinage du pétrole.
-Il est utilisé comme agent de nettoyage dans divers produits industriels et commerciaux, étant utilisé sur diverses surfaces, y compris: l'acier inoxydable, la porcelaine, le verre et le four.
-De plus, il est utilisé dans la production de détergents, de savons, de produits pharmaceutiques et d'encres..
Dans l'agriculture
Bien qu'il ne soit pas administré directement comme engrais, l'hydroxyde d'ammonium remplit cette fonction. L'ammoniac est produit à partir de l'azote atmosphérique par la méthode Haber-Bosch et est transporté réfrigéré en dessous de son point d'ébullition (-33 ºC) vers les sites d'utilisation.
L'ammoniac sous pression est injecté, sous forme de vapeur, dans le sol où il réagit immédiatement avec l'eau édaphique et passe sous forme d'ammonium (NH4+), qui est retenu dans les sites d'échange cationique du sol. De plus, de l'hydroxyde d'ammonium est produit. Ces composés sont une source d'azote.
Avec le phosphore et le potassium, l'azote constitue la triade des principaux nutriments végétaux essentiels à leur croissance..
Les références
- Ganong, W. F. (2002). Physiologie médicale. 19e édition. Éditorial du manuel moderne.
- A. D. Fortes, J. P. Brodholt, I. G. Wood et L. Vocadlo. (2001). Simulation ab initio du monohydrate d'ammoniac (NH3∙ HdeuxO) et d'hydroxyde d'ammonium (NH4OH). Institut américain de physique. J. Chem. Phys., Vol. 115, n ° 15, 15.
- Helmenstine, Anne Marie, Ph.D. (6 février 2017). Faits sur l'hydroxyde d'ammonium. Récupéré de: thinkco.com
- Groupe Pochteca. (2015). L'hydroxyde d'ammonium. pochteca.com.mx
- NJ Health. (s.f.). Fiche d'information sur les substances dangereuses: Hydroxyde d'ammonium. [PDF]. Récupéré de: nj.gov
- Apprenant en chimie. (2018). L'hydroxyde d'ammonium. Récupéré de: chemistrylearner.com
- PubChem. (2018). L'hydroxyde d'ammonium. Récupéré de: pubchem.ncbi.nlm.nih.gov



Personne n'a encore commenté ce post.