
Structure de l'hydroxyde de cuivre (II), propriétés, nomenclature, utilisations

le hydroxyde de cuivre (II) o L'hydroxyde cuivrique est un solide inorganique cristallin bleu pâle ou bleu-vert dont la formule chimique est Cu (OH)deux. Il est obtenu sous forme de précipité bleu volumineux en ajoutant un hydroxyde alcalin à des solutions cuivriques (cela signifie qu'ils contiennent des ions Cudeux+). C'est un composé instable.
Pour augmenter sa stabilité, il est préparé en présence d'ammoniaque (NH3) ou des phosphates S'il est préparé en présence d'ammoniac, un matériau avec une bonne stabilité et une granulométrie importante est produit.

Lorsqu'il est préparé à partir de phosphate de cuivre (II), Cu3(PO4)deux, on obtient un matériau avec une granulométrie plus fine et une plus grande surface spécifique. L'hydroxyde cuivrique est largement utilisé comme fongicide et bactéricide en agriculture et pour traiter le bois, prolongeant sa durée de vie utile..
Il est également utilisé comme complément alimentaire pour les animaux. Il est utilisé comme matière première pour obtenir d'autres sels de cuivre (II) et en galvanoplastie pour revêtir les surfaces.
Des études sont en cours pour estimer son potentiel de lutte contre les infections bactériennes et fongiques chez l'homme..
Index des articles
- 1 Structure
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Point de fusion
- 3.4 Densité
- 3.5 Solubilité
- 3.6 Autres propriétés
- 4 utilisations
- 4.1 Dans l'agriculture
- 4.2 Dans la préservation du bois
- 4.3 Dans la fabrication de la rayonne
- 4.4 Dans l'industrie de l'alimentation animale
- 4.5 Dans la fabrication d'autres composés de cuivre (II)
- 4.6 Autres utilisations
- 4.7 Applications médicales futures
- 5 Références
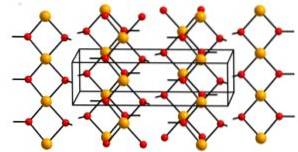
Structure
L'hydroxyde de cuivre (II) contient des chaînes infinies d'ions cuivre (Cudeux+) liés par des ponts de groupes hydroxyle (OH-).
Les chaînes sont si compactes que 2 atomes d'oxygène des autres chaînes sont au-dessus et au-dessous de chaque atome de cuivre, supposant ainsi une configuration octaédrique déformée, ce qui est courant dans la plupart des composés de cuivre (II)..
Dans sa structure, quatre atomes d'oxygène sont à une distance de 1,93 A; deux atomes d'oxygène sont à 2,63 A; et la distance Cu-Cu est de 2,95 A.
Nomenclature
- Hydroxyde de cuivre (II).
- Hydroxyde cuivrique.
- Dihydroxyde de cuivre.
Propriétés
État physique
Solide cristallin.
Poids moléculaire
99,58 g / mol.
Point de fusion
Il se décompose avant de fondre. Point de dégradation 229 ºC.
Densité
3,37 g / cm3
Solubilité
Il est pratiquement insoluble dans l'eau: 2,9 microgrammes / L à 25 ° C. Rapidement soluble dans les acides, dans les solutions alcalines concentrées et dans l'hydroxyde d'ammonium. Insoluble dans les solvants organiques. Dans l'eau chaude, il se décompose en générant de l'oxyde de cuivre (II), qui est plus stable.
Autres propriétés
Il est facilement soluble dans les acides forts et aussi dans les solutions concentrées d'hydroxyde alcalin, pour donner des anions bleu profond, probablement de la [Cun(OH)2n + 2]deux-.
Sa stabilité dépend de la méthode de préparation.
Il peut se décomposer et donner de l'oxyde de cuivre noir (II) (CuO) s'il reste au repos pendant quelques jours ou sous chauffage.
En présence d'un excès d'alcali, il se décompose au-dessus de 50 ºC.
Applications
En agriculture
L'hydroxyde de cuivre (II) a une large application comme fongicide et antibactérien dans les cultures agricoles. Voici quelques exemples:
- Il agit contre les taches bactériennes (de Erwinia) sur laitue, en application comme traitement foliaire.
- Contre les taches bactériennes (de Xanthomonas pruni) dans les pêches, pour lesquelles un traitement dormant et foliaire est appliqué.
- Il est utilisé contre les ravageurs des feuilles et des tiges des bleuets grâce à des applications latentes.
- Contre la pourriture pendant le stockage des myrtilles causée par Monilinia oxycocci, par application latente.
Pour l'application en agriculture, on utilise de l'hydroxyde de cuivre (II), qui est préparé en présence de phosphates en raison de sa petite taille de particules..

Dans la préservation du bois
Le bois, étant de nature organique, est sensible aux attaques d'insectes et de micro-organismes. L'hydroxyde de cuivre (II) est utilisé comme biocide pour les champignons qui attaquent le bois.
Il est généralement utilisé en conjonction avec un composé d'ammonium quaternaire (NH4+). L'hydroxyde de cuivre agit comme un fongicide et le composé d'ammonium quaternaire agit comme un insecticide..
De cette manière, le bois traité résiste ou résiste aux conditions de service, atteignant le niveau de performance requis par l'utilisateur. Cependant, le bois traité avec ces composés a un niveau élevé de cuivre et est très corrosif pour l'acier commun, il faut donc un type d'acier inoxydable capable de résister au traitement du bois traité..
Malgré son utilité, l'hydroxyde de cuivre (II) est considéré comme un biocide légèrement dangereux.
Pour cette raison, on craint qu'il soit rejeté du bois traité dans l'environnement en quantités qui pourraient être nocives pour les micro-organismes naturellement présents dans les eaux (rivières, lacs, zones humides et mer) ou le sol..
Dans la fabrication de la rayonne
Depuis le 19e siècle, des solutions d'ammoniaque d'hydroxyde de cuivre (II) sont utilisées pour dissoudre la cellulose. C'est l'une des premières étapes pour obtenir la fibre appelée rayonne en utilisant la technologie développée par Bemberg en Allemagne..
L'hydroxyde de cuivre (II) se dissout dans une solution d'ammoniaque (NH3), formant un sel complexe.
Les fibres courtes de coton raffinées sont ajoutées à la solution de cuivre-ammoniac contenant l'hydroxyde de cuivre (II) sous forme d'un solide précipité..
La cellulose de coton forme un complexe avec l'hydroxyde de tétraammonium de cuivre se dissolvant dans la solution.
Cette solution est ensuite coagulée lors de son passage dans un dispositif d'extrusion..
En raison de son coût élevé, cette technologie a déjà été dépassée par la viscose. La technologie Bemberg n'est actuellement utilisée qu'au Japon.
Dans l'industrie de l'alimentation animale
Il est utilisé sous forme de traces dans l'alimentation animale, car c'est l'une des substances nécessaires comme micronutriments pour la nutrition complète des animaux..

En effet, chez les êtres vivants supérieurs, le cuivre est un élément essentiel, nécessaire à l'activité d'une variété d'enzymes contenant du cuivre..
Par exemple, il est contenu dans l'enzyme qui participe à la production de collagène et dans l'enzyme nécessaire à la synthèse de la mélanine, entre autres.
C'est un composé généralement reconnu comme sûr lorsqu'il est ajouté à des niveaux compatibles avec les bonnes pratiques alimentaires..

Dans la fabrication d'autres composés de cuivre (II)
Précurseur actif dans la production des composés de cuivre (II) suivants: naphténate de cuivre (II), 2-éthylhexanoate de cuivre (II) et savons de cuivre. Dans ces cas, on utilise de l'hydroxyde de cuivre (II), qui est synthétisé en présence d'ammoniac..
Autres utilisations
Il est utilisé dans la stabilisation du nylon, dans les électrodes de batterie; comme fixateur de couleur dans les opérations de teinture; comme pigment; dans les insecticides; dans le traitement et la coloration du papier; dans les catalyseurs, comme catalyseur dans la vulcanisation du caoutchouc polysulfure; comme pigment antisalissure; et en électrolyse, en galvanoplastie.
Futures applications médicales
L'hydroxyde de cuivre (II) fait partie des composés du cuivre qui sont étudiés sous forme de nanoparticules pour l'élimination de bactéries telles que E. coli, K. pneumoniae, P. aeruginosa, Salmonella spp., entre autres, causant des maladies chez l'homme.
Il a également été constaté que les nanoparticules de cuivre peuvent être efficaces contre Candida albicans, un champignon qui est une cause fréquente de pathologies humaines.
Cela indique que la nanotechnologie du cuivre peut jouer un rôle important contre les bactéries et les champignons qui causent des infections chez l'homme, et l'hydroxyde de cuivre (II) pourrait être très utile dans ces domaines..
Les références
- Cotton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley et fils.
- Kirk-Othmer (1994). Encyclopédie de la technologie chimique. Volume 7. Quatrième édition. John Wiley et fils.
- Encyclopédie Ullmann de chimie industrielle. (1990). Cinquième édition. Volume A7. VCH Verlagsgesellschaft mbH.
- Bailar, J. C.; Emeléus, H.J.; Sir Ronald Nyholm et Trotman-Dickenson, A.F. (1973). Chimie inorganique complète. Volume 3. Pergamon Press.
- Bibliothèque nationale de médecine. (2019). Hydroxyde de cuivre (II). Récupéré de: pubchem.ncbi.nlm.nih.gov
- Schiopu, N. et Tiruta-Barna, L. (2012). Produits de préservation du bois. In Toxicité des matériaux de construction. Chapitre 6. Récupéré de sciencedirect.com.
- Mordorski, B. et Friedman, A. (2017). Nanoparticules métalliques pour l'infection microbienne. Dans les nanomatériaux fonctionnalisés pour la gestion des infections microbiennes. Chapitre 4. Récupéré de sciencedirect.com.
- Takashi Tsurumi. (1994). Solution en rotation. En technologie avancée de filage de fibre. Chapitre 3. Récupéré de sciencedirect.com.


Personne n'a encore commenté ce post.