
Structure de l'hydroxyde de fer (II), propriétés, utilisations
le hydroxyde de fer (II), également appelé hydroxyde ferreux, c'est un composé inorganique de formule chimique Fe (OH)deux. Si votre pureté est élevée, votre solide se compose uniquement d'ions Fedeux+ et OH- dans un rapport 2: 1; cependant, il peut contenir des molécules d'eau et différentes espèces ioniques, changeant la position.
Il représente la forme «réduite» de la fameuse rouille, une surface rougeâtre composée d'ions Fe.3+; tandis que dans la rouille verdâtre, Fe prédominedeux+, à côté de l'OH- et autre quantité d'anions: CO3deux-, SW4deux-, NE PAS3- et halogénures (F-, Cl-,… ), par exemple. Le résultat, bien que la base de cette rouille verte soit Fe (OH)deux, est que divers solides sont obtenus.

Dans la vie quotidienne, cet hydroxyde peut être vu dans les lieux communs. Par exemple, le bateau de l'image ci-dessus a sa surface recouverte de rouille verte (pas de patine). Il y a la foi (OH)deux, mais accompagné de nombreux ions des vagues de la mer.
Chimiquement parlant, les propriétés et les utilisations de ce matériau dépendent du cation Fe.deux+ et sa tendance à s'oxyder pour devenir le Fe3+. C'est un agent réducteur qui réagit rapidement avec l'oxygène dans des conditions basiques. Par conséquent, il doit être utilisé dans des atmosphères inertes et dans des solutions acides..
Index des articles
- 1 Structure de l'hydroxyde de fer (II)
- 1.1 Liens
- 1.2 Double couches d'hydroxyde
- 1.3 Hydrate
- 1.4 Rouille verte et rouge
- 2 propriétés
- 3 utilisations
- 3.1 Analyse organique qualitative
- 3.2 Réducteur d'oxoanion de sélénium
- 3.3 Matériaux à double couche
- 4 Références
Structure de l'hydroxyde de fer (II)
Liens
Considérant uniquement Fe (OH)deux pur, n'a que des ions Fedeux+ et OH-.
Les interactions entre eux doivent, en théorie, être de nature ionique; chaque cation Fedeux+ attire deux anions OH-, dont les attractions non directionnelles finissent par établir un ordre structurel et répétitif qui définit un cristal; qui à son tour, donne lieu à de la poussière de rouille verte.
Le problème est qu'il existe un certain caractère covalent entre les deux ions, et par conséquent, une liaison ionique Fe-OH ne peut être ignorée. Considérant une liaison Fe-OH partiellement ionique, on comprend qu'ils sont regroupés dans une sorte de couche polymérique.
Double couches d'hydroxyde
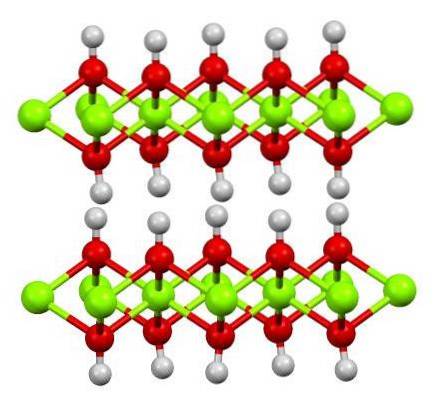
La structure de l'hydroxyde ferreux pur est illustrée ci-dessus avec un modèle boule et bâton. Les cations Fedeux+ sont représentés par les sphères vert clair, tandis que les anions OH- par les sphères rouges et blanches. Remarquez comment les ions Fe s'alignentdeux+ grâce aux interactions (ioniques-covalentes) avec l'OH-.
Pourquoi cette structure est-elle appelée double couche d'hydroxyde? L'image elle-même offre la réponse: il y a deux lignes ou couches de OH- pour chacun de Faithdeux+; c'est-à-dire que le rapport 2: 1 de Fe (OH) est maintenudeux mentionné au début.
Unités structurelles pour Fe (OH)deux sont alors ces sandwichs, où les couches d'OH- ils venaient représenter les pains; pains chargés négativement qui ne prennent donc pas correctement pour définir un cristal brun frappant.
Mais d'un autre côté, les atomes H s'alignent et s'obscurcissent également. Rappelant le concept de polarité et d'électronégativité, ces hydrogènes ont une légère charge partielle positive, δ +; qui, bien que faible, peut avoir une zone positive où d'autres anions ou molécules sont logés.
Hydrate
Quand le Fe (OH)deux se dissout dans l'eau, ses molécules se coordonnent avec le centre métallique de Fedeux+ pour former un complexe aqueux: [Fe (HdeuxOU ALORS)4(OH)deux]. Ce complexe a une géométrie octaédrique car il possède six ligands: quatre molécules d'eau et deux molécules OH.-. Cependant, dans l'hydroxyde ferreux hydraté, l'image est un peu différente..
Dans l'hydrate, de formule hypothétique Fe (OH)deuxNHdeuxOu bien, les molécules d'eau sont logées exactement entre les deux couches d'hydroxyde; c'est-à-dire qu'ils interagissent par des forces dipolaires avec des hydrogènes ou des sphères blanches. C'est comme si deux sandwichs OHFeOH étaient saisis et de l'eau insérée pour les regrouper: OHFeOH (HdeuxO) OHFeOH.
Les molécules d'eau sont très dynamiques, empêchant les particules d'hydrate d'acquérir des tailles importantes et, par conséquent, elles forment un solide colloïdal ou gélatineux..
Rouille verte et rouge
Dans les hydrates, les couches d'hydroxyde ont des molécules d'eau intercalées; cependant, ils peuvent avoir d'autres anions (déjà mentionnés), provoquant une grande variété de rouilles vertes. De même, ils peuvent même «piéger» des molécules aussi grosses que l'ADN ou des médicaments.
Non seulement les ions Fe peuvent être présentsdeux+, mais aussi Faith3+, produit de l'oxydation interne causée par l'oxygène intercalé. On observerait visiblement que la rouille verte (ou oxyde) commence à devenir rougeâtre à mesure que la concentration de Fe augmente.3+.
Propriétés

Fe (OH) illustré ci-dessusdeux précipité dans un tube à essai. Étant dans une eau abondante, le complexe aqueux devrait prédominer sur la structure qui vient d'être mentionnée. Observez que la surface présente une couleur orange, un produit de l'oxydation du Fedeux+ à la foi3+ par l'oxygène de l'air; c'est-à-dire que cet hydroxyde est un agent réducteur:
Foideux+ <=> Foi3+ + et-
L'aspect physique de ce composé à l'état pur est celui d'un solide brun:

Qui, en fonction de son taux d'humidité, peut apparaître comme un solide vert gélatineux. Il est assez insoluble dans l'eau (Ksp= 8 10-16 et solubilité = 0,72 g / 100 ml à 25 ° C), et a une masse molaire de 89,86 g / mol et une densité de 3,4 g / ml.
Aucun point d'ébullition ou de fusion n'est indiqué pour ce composé; probablement en raison du fait que, avant une source de chaleur, il se déshydrate et se transforme en oxyde ferreux, FeO:
Fe (OH)deux => FeO + HdeuxOU ALORS
Applications
Analyse organique qualitative
Son pouvoir réducteur permet de déterminer la présence de composés nitrés, RNOdeux. La réaction pour laquelle un test positif est obtenu est représentée par l'équation chimique suivante:
RNOdeux + 6Fe (OH)deux + 4HdeuxO => RNHdeux + 6Fe (OH)3
Le Fe (OH)3 précipite sous forme d'un solide brun rougeâtre, ce qui certifie la présence du groupe nitro, -NOdeux.
Réducteur de sélénium oxoanion
Le pouvoir réducteur de Fe (OH)deux il a également été utilisé pour réduire les anions SeO3deux- (sélénite) et SeO4deux- (sélénate) en sélénium élémentaire, Se. Pratiquement, il permet l'élimination de tels anions, nocifs pour la santé, sous la forme d'un solide sélénium insoluble et facilement extractible.
Matériaux double couche
Sa structure pure et la rouille verte sont une source d'inspiration pour la conception de nouveaux matériaux aux caractéristiques minéralogiques..
On estime que leur fonction est de permettre le transport d'une espèce spécifique entre ses couches, de manière à ce que son rejet sur le site actif (sols, cellules, surface métallique, etc.) puisse être contrôlé ou réduit..
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). Hydroxyde de fer (II). Récupéré de: en.wikipedia.org
- Centre national d'information sur la biotechnologie. (2019). Hydroxyde ferreux. Base de données PubChem. CID = 10129897. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Nick Doe. (s.f.). Tests pour les groupes phénols et nitro. Chimie 211. Récupéré de: academics.wellesley.edu
- Clark Jim. (27 avril 2019). Chimie du fer. Chimie LibreTexts. Récupéré de: chem.libretexts.org
- Logiciel technique de Kingston. (2019). Chimie de la rouille. Médecins de la corrosion. Récupéré de: corrosion-doctors.org
- Zingaro, Ralph A. et al. (1997). Réduction des anions oxosélénium par l'hydroxyde de fer (II). Environnement International. 23 (3): 299-304. doi: 10.1016 / S0160-4120 (97) 00032-9



Personne n'a encore commenté ce post.