
Structure, propriétés et utilisations de l'hydrure de béryllium (BeH2)
le hydrure de béryllium C'est un composé covalent formé entre le béryllium et l'hydrogène de métal alcalino-terreux. Sa formule chimique est BeHdeux, et étant covalent, il ne se compose pas d'ions Bedeux+ ni H-. C'est, avec LiH, l'un des hydrures métalliques les plus légers capables d'être synthétisés.
Il est produit en traitant le diméthylberyllium, Be (CH3)deux, avec de l'hydrure de lithium et d'aluminium, LiAlH4. Cependant, le BeHdeux plus pur est obtenu à partir de la pyrolyse du di-tert-butylbéryle, Be (C (CH3)3)deux à 210 ºC.

En tant que molécule individuelle à l'état gazeux, sa géométrie est linéaire, mais à l'état solide et liquide, elle polymérise en réseaux de réseaux tridimensionnels. C'est un solide amorphe dans des conditions normales, et peut devenir cristallin et présenter des propriétés métalliques sous une pression énorme..
Il représente une méthode possible de stockage de l'hydrogène, soit comme source d'hydrogène lors de la décomposition, soit comme gaz absorbant solide. Cependant, le BeHdeux il est très toxique et polluant étant donné la nature hautement polarisante du béryllium.
Index des articles
- 1 Structure chimique
- 1.1 Molécule BeH2
- 1.2 Chaînes BeH2
- 1.3 Réseaux tridimensionnels de BeH2
- 2 propriétés
- 2.1 Caractère covalent
- 2.2 Formule chimique
- 2.3 Apparence physique
- 2.4 Solubilité dans l'eau
- 2.5 Solubilité
- 2.6 Densité
- 2.7 Réactivité
- 3 utilisations
- 4 Références
Structure chimique
Molécule BeHdeux
La première image montre une seule molécule d'hydrure de béryllium à l'état gazeux. Notez que sa géométrie est linéaire, avec les atomes H séparés les uns des autres par un angle de 180º. Pour expliquer cette géométrie, l'atome Be doit avoir une hybridation sp.
Le béryllium a deux électrons de valence, qui sont situés dans l'orbitale 2s. Selon la théorie des liaisons de valence, l'un des électrons de l'orbitale 2s est énergétiquement promu vers l'orbitale 2p; et par conséquent, vous pouvez maintenant former deux liaisons covalentes avec les deux orbitales hybrides sp.
Et qu'en est-il du reste des orbitales libres du Be? Deux autres orbitales 2p pures et non hybridées sont disponibles. Avec eux vides, le BeHdeux C'est un composé déficient en électrons sous forme gazeuse; et par conséquent, au fur et à mesure que ses molécules se refroidissent et s'agglutinent, elles se condensent et se cristallisent en un polymère.
Chaînes BeHdeux
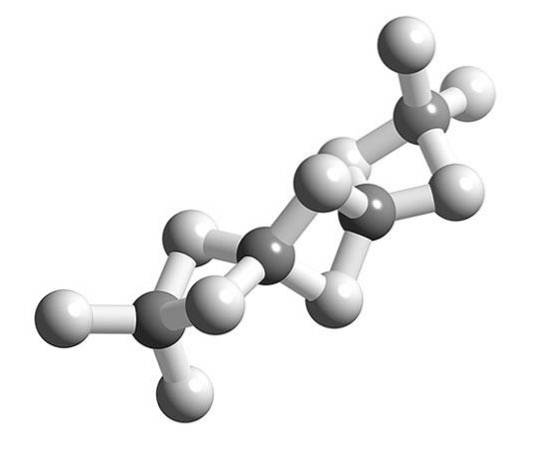
Quand les molécules BeHdeux polymériser, la géométrie environnante de l'atome Be cesse d'être linéaire et devient tétraédrique.
Auparavant, la structure de ce polymère était modélisée comme s'il s'agissait de chaînes avec des unités BeHdeux liés par des liaisons hydrogène (image du haut, avec les sphères dans des tons blancs et grisâtres). Contrairement aux liaisons hydrogène des interactions dipôle-dipôle, elles ont un caractère covalent.
Dans le pont Be-H-Be du polymère, deux électrons sont répartis entre les trois atomes (lien 3c, 2e), qui devrait théoriquement être situé avec une plus grande probabilité autour de l'atome d'hydrogène (étant plus électronégatif).
D'autre part, le Be entouré de quatre H parvient à combler relativement sa vacance électronique, complétant son octet de valence.
Ici, la théorie du lien de valence est dérisoire pour donner une explication relativement précise. Parce que? Parce que l'hydrogène ne peut avoir que deux électrons, et la liaison -H- impliquerait la participation de quatre électrons.
Ainsi, pour expliquer les ponts Be-Hdeux-Be (deux sphères grises jointes par deux sphères blanches) d'autres modèles complexes de la liaison sont nécessaires, tels que ceux fournis par la théorie des orbitales moléculaires.
Il a été constaté expérimentalement que la structure polymère de BeHdeux pas réellement une chaîne, mais un réseau tridimensionnel.
Réseaux tridimensionnels de BeHdeux

L'image du haut montre une section du réseau tridimensionnel de BeHdeux. Notez que les sphères vert jaunâtre, les atomes Be, forment un tétraèdre comme dans la chaîne; cependant, dans cette structure, il y a un plus grand nombre de liaisons hydrogène, et de plus, l'unité structurelle n'est plus le BeHdeux mais le BeH4.
Les mêmes unités structurelles BeHdeux et BeH4 indiquent qu'il y a une plus grande abondance d'atomes d'hydrogène dans le réseau (4 atomes H pour chaque Be).
Cela signifie que le béryllium dans ce réseau parvient à fournir sa vacance électronique encore plus que dans une structure polymère en forme de chaîne..
Et comme la différence la plus évidente de ce polymère par rapport à la molécule individuelle de BeHdeux, est que le Be doit nécessairement avoir une hybridation sp3 (généralement) pour expliquer les géométries tétraédriques et non linéaires.
Propriétés
Caractère covalent
Pourquoi l'hydrure de béryllium est-il un composé covalent et non ionique? Les hydrures des autres éléments du groupe 2 (M. Becamgbara) sont ioniques, c'est-à-dire qu'ils sont constitués de solides formés par un cation Mdeux+ et deux anions hydrure H- (MgHdeux, CaHdeux, Bahdeux). Par conséquent, le BeHdeux ne se compose pas de Bedeux+ ni H- interagir électrostatiquement.
Le cation Bedeux+ il se caractérise par son fort pouvoir polarisant, qui déforme les nuages électroniques des atomes environnants.
En raison de cette distorsion, les anions H- ils sont obligés de former des liaisons covalentes; liens, qui sont la pierre angulaire des structures qui viennent d'être expliquées.
Formule chimique
BeHdeux ou (BeHdeux) n
Aspect physique
Solide amorphe incolore.
Solubilité dans l'eau
Il se décompose.
Solubilité
Insoluble dans l'éther diéthylique et le toluène.
Densité
0,65 g / cm3 (1,85 g / L). La première valeur peut faire référence à la phase gazeuse et la seconde au solide polymère.
Réactivité
Réagit lentement avec l'eau, mais est rapidement hydrolysé par HCl pour former du chlorure de béryllium, BeCldeux.
L'hydrure de béryllium réagit avec les bases de Lewis, en particulier la triméthylamine, N (CH3)3, pour former un adduit dimère, avec des hydrures de pontage.
En outre, il peut réagir avec la diméthylamine pour former du diamide de béryllium trimérique, [Be (N (CH3)deux)deux]3 et l'hydrogène. La réaction avec l'hydrure de lithium, où l'ion H- est la base de Lewis, forme séquentiellement LIBeH3 et LideuxBeH4.
Applications
L'hydrure de béryllium pourrait représenter un moyen prometteur de stocker l'hydrogène moléculaire. Au fur et à mesure que le polymère se décompose, il libère Hdeux, qui servirait de carburant pour fusée. À partir de cette approche, le réseau tridimensionnel stockerait plus d'hydrogène que les chaînes.
De même, comme on peut le voir sur l'image du réseau, il existe des pores qui permettraient de loger les molécules H.deux.
En fait, certaines études simulent à quoi ressemblerait un tel stockage physique dans BeHdeux cristalline; c'est-à-dire le polymère soumis à d'énormes pressions et quelles seraient ses propriétés physiques avec différentes quantités d'hydrogène adsorbé.
Les références
- Wikipédia. (2017). Hydrure de béryllium. Récupéré de: en.wikipedia.org
- Armstrong, D.R., Jamieson, J. et Perkins, P.G. Théorète. Chim. Acta (1979) Les structures électroniques de l'hydrure de béryllium polymère et de l'hydrure de bore polymère. 51: 163. doi.org/10.1007/BF00554099
- Chapitre 3: Hydrure de béryllium et ses oligomères. Récupéré de: shodhganga.inflibnet.ac.in
- Vikas Nayak, Suman Banger et U. P. Verma. (2014). Etude du comportement structurel et électronique de BeHdeux comme composé de stockage de l'hydrogène: une approche ab initio. Documents de conférence en science, vol. 2014, numéro d'article 807893, 5 pages. doi.org/10.1155/2014/807893
- Shiver et Atkins. (2008). Chimie inorganique. Dans Les éléments du groupe 1. (Quatrième édition). Mc Graw Hill.


Personne n'a encore commenté ce post.