
Histoire du rubidium, propriétés, structure, obtention, utilisations
le rubidium C'est un élément métallique qui appartient au groupe 1 du tableau périodique: celui des métaux alcalins, étant représenté par le symbole chimique Rb. Son nom ressemble à celui du rubis, et c'est parce que lorsqu'il a été découvert, son spectre d'émission présentait des lignes caractéristiques de couleur rouge foncé..
C'est l'un des métaux les plus réactifs qui existent. C'est le premier des métaux alcalins qui, bien que peu dense, s'enfonce dans l'eau. Il réagit également avec lui de manière plus explosive que le lithium, le sodium et le potassium. Il y a eu des expériences dans lesquelles des cloques éclatent là où elles sont stockées (image du bas) pour tomber et exploser dans des baignoires.

Le rubidium se distingue par le fait qu'il est un métal plus cher que l'or lui-même; pas tant à cause de sa rareté, mais à cause de sa large distribution minéralogique dans la croûte terrestre et des difficultés qui surviennent lors de son isolement des composés de potassium et de césium..
Il montre une nette tendance à s'associer au potassium dans ses minéraux, se trouvant sous forme d'impuretés. Non seulement en matière géochimique, il forme un duo avec le potassium, mais aussi dans le domaine de la biochimie.
L'organisme «confond» les ions K+ par ceux de Rb+; cependant, le rubidium n'est pas un élément essentiel à ce jour, car son rôle dans le métabolisme est inconnu. Même ainsi, les suppléments de rubidium ont été utilisés pour soulager certaines conditions médicales telles que la dépression et l'épilepsie. D'autre part, les deux ions dégagent une flamme violette à la chaleur du briquet.
En raison de son coût élevé, ses applications ne sont pas trop basées sur la synthèse de catalyseurs ou de matériaux, mais en tant que composant pour divers dispositifs avec des bases physiques théoriques. L'un d'eux est l'horloge atomique, les cellules solaires et les magnétomètres. C'est pourquoi le rubidium est parfois considéré comme un métal sous-estimé ou sous-étudié..
Index des articles
- 1 Histoire
- 2 Propriétés physiques et chimiques
- 2.1 Apparence
- 2.2 Numéro atomique (Z)
- 2.3 Masse molaire
- 2.4 Point de fusion
- 2.5 Point d'ébullition
- 2.6 Densité
- 2.7 Chaleur de fusion
- 2.8 Chaleur de vaporisation
- 2.9 Electronégativité
- 2.10 Affinité électronique
- 2.11 Énergies d'ionisation
- 2.12 Rayon atomique
- 2.13 Conductivité thermique
- 2.14 Résistivité électrique
- 2.15 dureté Mohs
- 2.16 Réactivité
- 3 Structure et configuration électronique
- 3.1 nombres d'oxydation
- 3.2 Clusters
- 4 Où trouver et obtenir
- 4.1 Croûte terrestre
- 4.2 Association géochimique
- 4.3 Cristallisation fractionnée
- 4.4 Electrolyse ou réduction
- 5 isotopes
- 6 risques
- 6.1 Métal
- 6.2 Ions
- 7 utilisations
- 7.1 Collecteur de gaz
- 7.2 Pyrotechnie
- 7.3 Supplément
- 7.4 Condensat de Bose-Einstein
- 7.5 Diagnostic des tumeurs
- 7.6 Composant
- 7.7 Horloges atomiques
- 8 Références
Histoire
Le rubidium a été découvert en 1861 par les chimistes allemands Robert Bunsen et Gustav Kirchhoff, à l'aide de la spectroscopie. Pour ce faire, ils ont utilisé le bec Bunsen et le spectroscope, inventés deux ans plus tôt, ainsi que des techniques de précipitation analytique. Son objet d'étude était la lépidolite minérale, dont l'échantillon a été collecté en Saxe, en Allemagne..
Ils ont commencé à partir de 150 kg de minéral de lépidolite, qu'ils ont traité avec de l'acide chloroplatinique, HdeuxPtCl6, pour précipiter l'hexachloroplatinate de potassium, KdeuxPtCl6. Cependant, lorsqu'ils ont étudié son spectre en le brûlant dans le brûleur Bunsen, ils se sont rendu compte qu'il présentait des raies d'émission qui ne coïncidaient à ce moment-là avec aucun autre élément..
Le spectre d'émission de ce nouvel élément se caractérise par la présence de deux raies bien définies dans la région rouge. C'est pourquoi ils l'ont baptisé du nom de «rubidus» qui signifie «rouge foncé». Plus tard, Bunsen et Kirchhoff ont réussi à séparer le RbdeuxPtCl6 de KdeuxPtCl6 par cristallisation fractionnée; pour finalement le réduire en son sel chlorure en utilisant de l'hydrogène.
Identifiant et isolant un sel du nouvel élément rubidium, les chimistes allemands n'avaient qu'à le réduire à son état métallique. Pour y parvenir, ils ont essayé de deux manières: appliquer une électrolyse au chlorure de rubidium ou chauffer un sel plus facile à réduire, tel que son tartrate. C'est ainsi que le rubidium métallique est né.
Proprietes physiques et chimiques
Apparence
Métal doux gris argenté. Il est si lisse qu'il ressemble à du beurre. Il est généralement emballé dans des ampoules en verre, dans lesquelles prédomine une atmosphère inerte qui le protège de la réaction avec l'air..
Numéro atomique (Z)
37
Masse molaire
85,4678 g / mol
Point de fusion
39 ºC
Point d'ébullition
688 ºC
Densité
À température ambiante: 1,532 g / cm3
Au point de fusion: 1,46 g / cm3
La densité du rubidium est supérieure à celle de l'eau, il coulera donc en réagissant violemment avec lui.
Température de fusion
2,19 kJ / mol
Chaleur de vaporisation
69 kJ / mol
Électronégativité
0,82 sur l'échelle de Pauling
Affinité électronique
46,9 kJ / mol
Énergies d'ionisation
-Premièrement: 403 kJ / mol (Rb+ gazeux)
-Deuxième: 2632,1 kJ / mol (Rbdeux+ gazeux)
-Troisième: 3859,4 kJ / mol (Rb3+ gazeux)
Radio atomique
248 pm (empirique)
Conductivité thermique
58,2 W / (mK)
Résistivité électrique
128 nΩm à 20 ° C
Dureté Mohs
0.3. Par conséquent, même le talc est plus dur que le rubidium métallique..
Réactivité

Le rubidium est l'un des métaux alcalins les plus réactifs, après le césium et le francium. Dès qu'il est exposé à l'air, il commence à brûler, et s'il est frappé, il tire de légères étincelles. S'il est chauffé, il émet également une flamme violette (image du haut), qui est un test positif pour les ions Rb.+.
Réagit avec l'oxygène pour former un mélange de peroxydes (RbdeuxOU ALORSdeux) et superoxydes (RbOdeux). Bien qu'il ne réagisse pas avec les acides et les bases, il réagit violemment avec l'eau, générant de l'hydroxyde de rubidium et de l'hydrogène gazeux:
Rb (s) + HdeuxO (l) => RbOH (aq) + Hdeux(g)
Réagit avec l'hydrogène pour former son hydrure correspondant:
Rb (s) + Hdeux(g) => 2RbH (s)
Et aussi avec des halogènes et du soufre de manière explosive:
2Rb (s) + Cldeux(g) => RbCl (s)
2Rb (s) + S (l) => RbdeuxH.H)
Bien que le rubidium ne soit pas considéré comme un élément toxique, il est potentiellement dangereux et présente des risques d'incendie lorsqu'il entre en contact avec l'eau et l'oxygène..
Structure et configuration électronique
Les atomes de rubidium sont disposés de telle manière qu'ils forment un cristal avec une structure cubique centrée sur le corps (bcc, pour son acronyme en anglais corps centré cubique). Cette structure est caractéristique des métaux alcalins, qui sont légers et ont tendance à flotter sur l'eau; sauf du rubidium vers le bas (césium et francium).
Dans les cristaux de rubidium bcc, leurs atomes Rb interagissent les uns avec les autres grâce à la liaison métallique. Celui-ci est régi par une «mer d'électrons» de sa coquille de valence, de l'orbitale 5s selon sa configuration électronique:
[Kr] 5s1
Toutes les orbitales 5s avec leur seul électron se chevauchent dans toutes les dimensions des cristaux de rubidium métalliques. Cependant, ces interactions sont faibles, car à mesure que l'on descend à travers le groupe de métal alcalin, les orbitales deviennent plus diffuses et, par conséquent, la liaison métallique s'affaiblit..
C'est pourquoi le point de fusion du rubidium est de 39 ° C. De même, sa faible liaison métallique explique la douceur de son solide; si doux qu'il ressemble à du beurre d'argent.
Il n'y a pas suffisamment d'informations bibliographiques concernant le comportement de ses cristaux sous haute pression; s'il y a des phases plus denses avec des propriétés uniques telles que le sodium.
Numéros d'oxydation
Sa configuration électronique indique aussitôt que le rubidium a fortement tendance à perdre son unique électron pour devenir isoélectronique au gaz rare krypton. Quand c'est le cas, le cation monovalent Rb se forme+. On dit alors que dans ses composés il a le numéro d'oxydation +1 lorsque l'existence de ce cation est supposée.
En raison de la tendance du rubidium à s'oxyder, l'hypothèse selon laquelle les ions Rb existent+ dans ses composés est correcte, ce qui indique à son tour le caractère ionique de ces composés.
Dans presque tous les composés de rubidium, il présente un indice d'oxydation de +1. Des exemples d'entre eux sont les suivants:
-Chlorure de rubidium, RbCl (Rb+Cl-)
-Hydroxyde de rubidium, RbOH (Rb+ Oh-)
-Carbonate de rubidium, RbdeuxCO3 (Rbdeux+CO3deux-)
-Monoxyde de rubidium, RbdeuxO (Rbdeux+OU ALORSdeux-)
-Superoxyde de rubidium, RbOdeux (Rb+OU ALORSdeux-)
Bien que très rare, le rubidium pourrait également avoir un indice d'oxydation négatif: -1 (Rb-). Dans ce cas, on parlerait d'un «rubidide» s'il formait un composé avec un élément moins électronégatif que lui, ou s'il était soumis dans des conditions particulières et rigoureuses.
Groupes
Il existe des composés dans lesquels chaque atome de Rb présente individuellement des nombres d'oxydation avec des valeurs fractionnaires. Par exemple, dans le Rb6O (Rb6deux+OU ALORSdeux-) et Rb9OU ALORSdeux (Rb94+OU ALORSdeuxdeux-) la charge positive est répartie entre un ensemble d'atomes Rb (amas). Ainsi, dans le Rb6Ou le nombre d'oxydation en théorie serait +1/3; tandis que dans le Rb9OU ALORSdeux, + 0,444 (4/9).
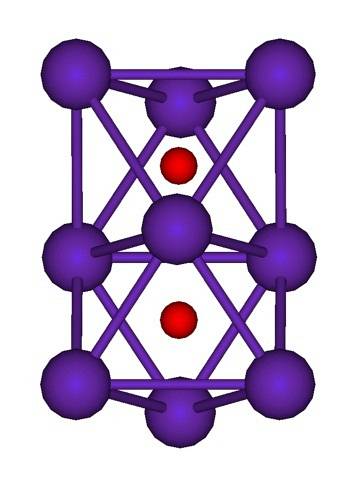
La structure de cluster de Rb est illustrée ci-dessus.9OU ALORSdeux représenté par un modèle de sphères et de barres. Notez comment les neuf atomes Rb «renferment» les anions O.deux-.
À titre d'élucubration, c'est comme si une partie des cristaux de rubidium métalliques d'origine restait inchangée pendant qu'ils étaient séparés du cristal mère. Ils perdent des électrons dans le processus; ceux nécessaires pour attirer l'Odeux-, et la charge positive résultante est répartie entre tous les atomes dudit amas (ensemble ou agrégats d'atomes Rb).
Ainsi, dans ces amas de rubidium, l'existence de Rb ne peut pas être formellement supposée.+. Le Rb6O et Rb9OU ALORSdeux Ils sont classés comme sous-oxydes de rubidium, dans lesquels cette anomalie apparente d'avoir un excès d'atomes métalliques par rapport aux anions oxydes est remplie.
Où trouver et obtenir
croûte terrestre

Le rubidium est le 23e élément le plus abondant de la croûte terrestre, avec une abondance comparable à celle des métaux zinc, plomb, césium et cuivre. Le détail est que ses ions sont largement diffusés, donc il ne prédomine dans aucun minéral comme élément métallique principal, et ses minerais sont également rares..
C'est pour cette raison que le rubidium est un métal très coûteux, encore plus que l'or lui-même, car son processus d'obtention à partir de ses minerais est complexe en raison de la difficulté de son exploitation..
Dans la nature, compte tenu de sa réactivité, le rubidium ne se trouve pas à l'état natif, mais sous forme d'oxyde (RbdeuxO), chlorure (RbCl) ou accompagné d'autres anions. Ses ions «libres» Rb+ se trouvent dans les mers à une concentration de 125 µg / L, ainsi que dans les sources chaudes et les rivières.
Parmi les minéraux de la croûte terrestre qui en contiennent à une concentration inférieure à 1%, nous avons:
-Leucite, K [AlSideuxOU ALORS6]
-Polucita, Cs (SideuxBonjour6NHdeuxOU ALORS
-Carnalite, KMgCl36HdeuxOU ALORS
-Zinnwaldite, KLiFeAl (AlSi3)OU ALORSdix(OH, F)deux
-Amazonite, Pb, KAlSi3OU ALORS8
-Pétalite, LiAlSi4OU ALORSdix
-Biotite, K (Mg, Fe)3AlSi3OU ALORSdix(OH, F)deux
-Rubicline, (Rb, K) AlSi3OU ALORS8
-Lépidolite, K (Li, Al)3(Oui, Al)4OU ALORSdix(F, OH)deux
Association géochimique
Tous ces minéraux ont un ou deux points communs: ce sont des silicates de potassium, de césium ou de lithium, ou ce sont des sels minéraux de ces métaux..
Cela signifie que le rubidium a une forte tendance à s'associer au potassium et au césium; Il peut même se substituer au potassium lors de la cristallisation de minéraux ou de roches, comme cela se produit dans les dépôts de pegmatites lorsque le magma cristallise. Ainsi, le rubidium est un sous-produit de l'exploitation et du raffinage de ces roches et de leurs minéraux..
Le rubidium peut également être trouvé dans les roches communes telles que le granit, les argiles et le basalte, et même dans les dépôts carbonifères. De toutes les sources naturelles, la lépidolite représente son principal minerai et à partir duquel elle est exploitée commercialement..
Dans la carnalite, par contre, le rubidium peut être trouvé sous forme d'impuretés RbCl avec une teneur de 0,035%. Et à une concentration plus élevée, il y a des dépôts de polucite et de rubicline, qui peuvent contenir jusqu'à 17% de rubidium..
Son association géochimique avec le potassium est due à la similitude de leurs rayons ioniques; le Rb+ est plus grand que K+, mais la différence de taille n'est pas un obstacle pour que le premier puisse remplacer le second dans ses cristaux minéraux.
Cristallisation fractionnée
Que ce soit à partir de la lépidolite ou de la polucite, ou avec l'un des minéraux mentionnés ci-dessus, le défi reste le même à un degré plus ou moins grand: séparer le rubidium du potassium et du césium; c'est-à-dire appliquer des techniques de séparation de mélanges qui permettent d'avoir des composés ou sels de rubidium d'une part, et ceux de potassium et de césium, d'autre part..
Ceci est difficile car ces ions (K+, Rb+ et Cs+) partagent une grande similitude chimique; Ils réagissent de la même manière pour former les mêmes sels, qui ne diffèrent guère les uns des autres grâce à leurs densités et solubilités. C'est pourquoi la cristallisation fractionnée est utilisée, afin qu'ils puissent cristalliser lentement et de manière contrôlée..
Par exemple, cette technique est utilisée pour séparer un mélange de carbonates et d'alun de ces métaux. Les processus de recristallisation doivent être répétés plusieurs fois pour garantir des cristaux de plus grande pureté et exempts d'ions coprécipités; un sel de rubidium qui cristallise avec des ions K+ ou Cs+ à sa surface ou à l'intérieur.
Des techniques plus modernes, telles que l'utilisation d'une résine échangeuse d'ions, ou des éthers couronnes comme agents complexants, permettent également l'isolement des ions Rb.+.
Électrolyse ou réduction
Une fois le sel de rubidium séparé et purifié, la prochaine et dernière étape consiste à réduire les cations Rb+ au métal solide. Pour ce faire, le sel est fondu et soumis à une électrolyse pour que le rubidium précipite sur la cathode; ou un agent réducteur fort est utilisé, tel que le calcium et le sodium, capable de perdre rapidement des électrons et de réduire ainsi le rubidium.
Les isotopes
Le rubidium se trouve sur Terre sous forme de deux isotopes naturels: le 85Rb et 87Rb. Le premier a une abondance de 72,17%, tandis que le second de 27,83%.
le 87Rb est responsable du fait que ce métal est radioactif; cependant, son rayonnement est inoffensif et même bénéfique pour l'analyse de datation. Sa demi-vie (t1/2) vaut 4,910dix ans, dont la durée dépasse l'âge de l'Univers. Lorsqu'il se désintègre, il devient l'isotope stable 87m.
Grâce à cela, cet isotope a été utilisé pour dater l'âge des minéraux et roches terrestres présents depuis le début de la Terre..
En plus des isotopes 85Rb et 87Rb, il y en a d'autres synthétiques et radioactifs avec des durées de vie variables et beaucoup plus courtes; Par exemple, lui 82Rb (t1/2= 76 secondes), 83Rb (t1/2= 86,2 jours), 84Rb (t1/2= 32,9 jours) et 86Rb (t1/2= 18,7 jours). De tous, le 82Le Rb est le plus utilisé dans les études médicales.
Des risques
Métal
Le rubidium est un métal si réactif qu'il doit être stocké dans des ampoules en verre sous atmosphère inerte afin qu'il ne réagisse pas avec l'oxygène de l'air. Si le blister se brise, le métal peut être placé dans du kérosène ou de l'huile minérale pour le protéger; cependant, il finira par être oxydé par l'oxygène dissous en eux, donnant lieu à des peroxydes de rubidium.
Si, au contraire, on décide de le placer sur du bois, par exemple, il finira par brûler avec une flamme violette. S'il y a beaucoup d'humidité, il brûlera simplement en étant exposé à l'air. Lorsqu'un gros morceau de rubidium est jeté dans un volume d'eau, il explose vigoureusement, enflammant même l'hydrogène gazeux produit.
Par conséquent, le rubidium est un métal que tout le monde ne devrait pas manipuler, car pratiquement toutes ses réactions sont explosives..
Ion
Contrairement au rubidium métallique, ses ions Rb+ ils ne représentent aucun risque apparent pour les êtres vivants. Ceux-ci dissous dans l'eau interagissent avec les cellules de la même manière que les ions K.+.
Par conséquent, le rubidium et le potassium ont des comportements biochimiques similaires; cependant, le rubidium n'est pas un élément essentiel, tandis que le potassium l'est. De cette manière, des quantités appréciables de Rb+ peut s'accumuler à l'intérieur des cellules, des globules rouges et des viscères sans nuire au corps d'un animal.
En fait, il a été estimé qu'un mâle adulte d'une masse de 80 kg contient environ 37 mg de rubidium; et qu'en plus, une augmentation de cette concentration de l'ordre de 50 à 100 fois n'entraîne pas de symptômes indésirables.
Cependant, un excès d'ions Rb+ peut finir par déplacer les ions K+; et par conséquent, l'individu souffrira de spasmes musculaires très forts jusqu'à la mort.
De toute évidence, les sels ou composés de rubidium solubles peuvent déclencher cela immédiatement, donc aucun d'entre eux ne doit être ingéré. De plus, il peut provoquer des brûlures par simple contact, et parmi les plus toxiques on peut citer le fluorure (RbF), l'hydroxyde (RbOH) et le cyanure (RbCN) de rubidium.
Applications
Collecteur de gaz
Le rubidium a été utilisé pour capturer ou éliminer les traces de gaz qui peuvent se trouver dans des tubes scellés sous vide. Précisément en raison de leur forte tendance à capter l'oxygène et l'humidité en eux, ils les éliminent à leur surface sous forme de peroxydes.
Pyrotechnie
Lorsque les sels de rubidium brûlent, ils dégagent une flamme rouge-violet caractéristique. Certains feux d'artifice ont ces sels dans leur composition afin qu'ils explosent avec ces couleurs.
Supplément
Le chlorure de rubidium a été prescrit pour lutter contre la dépression, car des études ont déterminé une carence de cet élément chez les personnes souffrant de cette condition médicale. Il a également été utilisé comme sédatif et pour traiter l'épilepsie.
Condensat de Bose-Einstein
Atomes isotopiques 87Les Rb ont été utilisés pour créer le premier condensat de Bose-Einstein. Cet état de la matière consiste en ce que les atomes, à une température assez proche du zéro absolu (0 K), sont groupés ou «condensés», se comportant comme s'ils ne faisaient qu'un..
Ainsi, le rubidium a été le protagoniste de ce triomphe dans le domaine de la physique, et ce sont Eric Cornell, Carl Wieman et Wolfgang Ketterle qui ont reçu le prix Nobel en 2001 grâce à ces travaux..
Diagnostic de tumeur
Le radio-isotope synthétique 82Le Rb se désintègre en émettant des positrons, qui sont utilisés pour s'accumuler dans les tissus riches en potassium; tels que ceux situés dans le cerveau ou le cœur. Il est ainsi utilisé pour analyser la fonctionnalité du cœur et la présence d'éventuelles tumeurs dans le cerveau au moyen d'une tomographie par émission de positons..
Composant
Les ions rubidium ont trouvé leur place dans différents types de matériaux ou de mélanges. Par exemple, ses alliages ont été fabriqués avec de l'or, du césium, du mercure, du sodium et du potassium. Il a été ajouté aux verres et aux céramiques probablement pour augmenter leur point de fusion.
Dans les cellules solaires, les pérovskites ont été ajoutées en tant que composant important. De même, son utilisation possible comme générateur thermoélectrique, matériau de transfert de chaleur dans l'espace, carburant dans les moteurs à propulsion ionique, milieu électrolytique pour batteries alcalines et dans les magnétomètres atomiques a également été étudiée..
Horloges atomiques
Avec du rubidium et du césium, les fameuses horloges atomiques de haute précision ont été fabriquées, utilisées par exemple dans les satellites GPS avec lesquels les propriétaires de leurs smartphones peuvent connaître leur emplacement en se déplaçant sur une route..
Les références
- Bond Tom. (29 octobre 2008). Rubidium. Récupéré de: chemistryworld.com
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). Rubidium. Récupéré de: en.wikipedia.org
- Centre national d'information sur la biotechnologie. (2019). Rubidium. Base de données PubChem. CID = 5357696. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Chellan, P. et Sadler, P. J. (2015). Les éléments de la vie et les médicaments. Transactions philosophiques. Série A, Sciences mathématiques, physiques et de l'ingénieur, 373 (2037), 20140182. doi: 10.1098 / rsta.2014.0182
- Fondation Mayo pour la formation et la recherche médicales. (2019). Rubidium Rb 82 (voie intraveineuse). Récupéré de: mayoclinic.org
- Marques Miguel. (s.f.). Rubidium. Récupéré de: nautilus.fis.uc.pt
- James L. Dye. (12 avril 2019). Rubidium. Encyclopædia Britannica. Récupéré de: britannica.com
- Dr Doug Stewart. (2019). Faits sur les éléments de rubidium. Chemicool. Récupéré de: chemicool.com
- Michael Pilgaard. (10 mai 2017). Réactions chimiques du rubidium. Récupéré de: pilgaardelements.com

Personne n'a encore commenté ce post.