
Caractéristiques, structure, types et fonctions des histones
le histones sont des protéines de base qui interagissent avec l'ADN pour la formation de nucléosomes, qui constituent les brins de chromatine qui composent les chromosomes dans les organismes eucaryotes.
Les nucléosomes, complexes composés d'ADN et de protéines, ont été découverts en 1974 et ce sont les histones qui assemblent ce niveau basal d'organisation de la chromatine. Cependant, l'existence de protéines histones est connue depuis avant les années 1960..
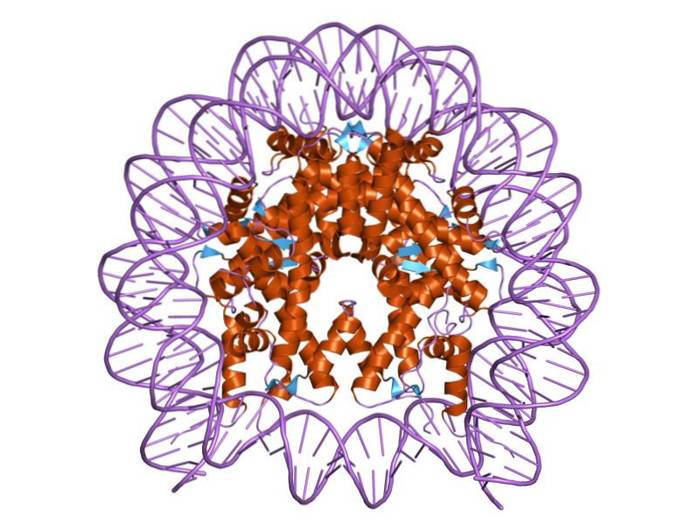
Les histones sont organisées de telle manière que l'ADN à double bande s'enroule autour d'un centre protéique composé de ces protéines qui interagissent étroitement les unes avec les autres. Le centre de l'histone a la forme d'un disque et l'ADN en fait environ 1,7 fois le tour..
De multiples liaisons hydrogène permettent à l'ADN de se lier au centre protéique formé par les histones dans chaque nucléosome. Ces liaisons sont formées, pour la plupart, entre les squelettes d'acides aminés des histones et le squelette sucre-phosphate de l'ADN. Certaines interactions hydrophobes et liaisons ioniques participent également.
Les protéines appelées «complexes de remodelage de la chromatine» sont responsables de la dégradation et de la formation des liaisons de jonction entre l'ADN et les histones, permettant l'entrée de la machinerie transcriptionnelle dans l'ADN contenu dans les nucléosomes.
Malgré la proximité des acides nucléiques avec le centre protéique formé par les histones, ceux-ci sont disposés de telle manière que, si nécessaire, ils permettent l'entrée de facteurs de transcription et d'autres protéines liées à l'expression génique ou au silençage génique..
Les histones peuvent subir diverses modifications qui génèrent de multiples variantes, rendant possible l'existence de nombreuses formes différentes de chromatine qui ont la propriété de moduler l'expression génétique de différentes manières..
Index des articles
- 1 Fonctionnalités
- 2 Structure
- 2.1 Histones de liaison
- 3 types
- 3.1 Histones nucléosomiques
- 3.2 Histones de liaison
- 4 fonctions
- 5 Références
Caractéristiques
Ils sont l'une des protéines eucaryotes les plus conservées dans la nature. Par exemple, il a été démontré que l'histone H4 de pois diffère dans seulement deux des 102 positions d'acides aminés de la protéine H4 de vache..
Les histones sont des protéines relativement petites, ne contenant pas plus de 140 acides aminés. Ils sont riches en résidus d'acides aminés basiques, ils ont donc une charge positive nette, ce qui contribue à leur interaction avec l'acide nucléique chargé négativement pour former des nucléosomes..
Les histones nucléosomiques et de pontage sont connues. Les histones nucléosomiques sont H3, H4, H2A et H2B, tandis que les histones de liaison appartiennent à la famille des histones H1.
Au cours de l'assemblage du nucléosome, des dimères spécifiques H3-H4 et H2A-H2B sont initialement formés. Deux dimères H3-H4 se rejoignent ensuite pour former des tétramères qui se combinent plus tard avec les dimères H2A-H2B, formant le centre octamérique..
Toutes les histones sont synthétisées principalement pendant la phase S du cycle cellulaire, et les nucléosomes sont assemblés dans les hélices d'ADN naissantes, juste après la fourche de réplication..
Structure
La structure générale des histones comprend une région d'acide aminé basique et une région carboxyle globulaire hautement conservée parmi les organismes eucaryotes..
Un motif structurel appelé «pli histone», composé de trois hélices alpha reliées par deux épingles à cheveux et formant un petit centre hydrophobe, est responsable des interactions protéine-protéine entre les histones qui composent le nucléosome..
C'est ce repli d'histones qui constitue le domaine carboxyle globulaire de ces protéines nucléosomiques chez tous les eucaryotes..
Les histones ont également de petites "queues" ou des régions amino-terminales et autres carboxyl-terminales (accessibles aux protéases), ne dépassant pas 40 acides aminés de long. Les deux régions sont riches en acides aminés basiques qui peuvent subir de multiples modifications covalentes post-traductionnelles..
Liaison d'histones
Chez les eucaryotes, il existe deux familles d'histones de liaison, différenciées l'une de l'autre par leur structure. Certains ont une structure tripartite, avec le domaine globulaire décrit ci-dessus flanqué de domaines N- et C-terminaux "non structurés"; tandis que d'autres n'ont qu'un domaine C-terminal.
Bien que la plupart des histones soient conservées, des variantes spécifiques peuvent apparaître au cours de l'embryogenèse ou de la maturation de cellules spécialisées dans certains organismes. Certaines variations structurelles concernent des modifications post-traductionnelles telles que les suivantes:
-Phosphorylation: on pense qu'il est lié à la modification du degré de condensation de la chromatine et il se produit couramment dans les résidus sérine.
-Acétylation: associé à des régions chromosomiques actives sur le plan transcriptionnel. Il se produit normalement sur les chaînes latérales des résidus de lysine. Lorsqu'elles se produisent sur ces résidus, leur charge positive diminue, diminuant ainsi l'affinité des protéines pour l'ADN..
-Méthylation: peut se produire sous forme de mono-, di- ou triméthylation de résidus de lysine qui dépassent du noyau protéique.
Des enzymes spécifiques sont responsables de ces modifications covalentes des histones. Ces enzymes comprennent les histone-acétyl transférases (HAT), les complexes histone-désacétylases (HDAC) et les histone-méthyltransférases et déméthylases..
Les types
La caractérisation des histones a été réalisée par diverses techniques biochimiques, parmi lesquelles se distinguent les chromatographies basées sur des résines échangeuses de cations faibles..
Certains auteurs établissent une forme de classification dans laquelle 5 principaux types d'histones sont distingués chez les eucaryotes: FI, avec des protéines de 21 kDa; F2A1 ou FIV, de plus ou moins 11,3 kDa; F2A2 ou FIIbI, 14,5 kDa; F2B ou FIIb2, d'un poids moléculaire de 13,7 kDa, et F3 ou FIII, de 15,3 kDa.
Tous ces types d'histones, à l'exception du groupe IF, se retrouvent en quantités équimolaires dans les cellules..
Une autre classification, de même validité et peut-être la plus largement utilisée aujourd'hui, propose l'existence de deux types d'histones différents, à savoir: celles qui font partie de l'octamère du nucléosome et les histones de liaison ou de pontage, qui rejoignent les nucléosomes entre Oui.
Certaines variantes peuvent également se produire entre les espèces et contrairement aux histones de noyau, les variantes sont synthétisées pendant l'interphase et sont insérées dans la chromatine préformée par un processus dépendant de l'énergie libérée par l'hydrolyse de l'ATP..
Histones nucléosomiques
Le centre d'un nucléosome se compose d'une paire de chacune des quatre histones constitutives: H2a, H2b, H3 et H4; sur lesquels sont enroulés des segments d'ADN d'environ 145 paires de bases.
Les histones H4 et H2B sont, en principe, invariables. Certaines variations sont cependant évidentes dans les histones H3 et H2A, dont les propriétés biophysiques et biochimiques altèrent la nature normale du nucléosome..
Variante de l'histone H2A chez l'homme, la protéine H2A.Z a une grande région acide et peut favoriser la stabilité des nucléosomes en fonction des variants d'histone H3 auxquels elle est associée..
Ces histones présentent une certaine variabilité entre les espèces, un cas particulier étant celui de l'histone H2B, pour laquelle le premier tiers de la molécule est très variable..
Liaison d'histones
Les histones de liaison ou de pontage sont des histones de classe H1. Ceux-ci sont responsables de l'union entre les nucléosomes et de la protection de l'ADN qui dépasse au début et à la fin de chaque particule..
Contrairement aux histones nucléosomiques, toutes les histones de type H1 ne possèdent pas la région globulaire du «pli» de l'histone. Ces protéines se lient à l'ADN entre les nucléosomes, facilitant un changement de l'équilibre de la chromatine vers un état plus condensé et moins actif, d'un point de vue transcriptionnel..
Des études ont lié ces histones au vieillissement, à la réparation de l'ADN et aux processus apoptotiques, c'est pourquoi on pense qu'ils jouent un rôle crucial dans le maintien de l'intégrité génomique..
Caractéristiques
Tous les résidus d'acides aminés des histones participent, d'une manière ou d'une autre, à leur interaction avec l'ADN, ce qui explique le fait qu'ils sont ainsi conservés parmi les règnes des organismes eucaryotes.
La participation des histones à l'empaquetage de l'ADN sous forme de chromatine est d'une grande importance pour les organismes multicellulaires complexes dans lesquels les différentes lignées cellulaires ne peuvent se spécialiser qu'en modifiant l'accessibilité de leurs gènes à la machinerie transcriptionnelle..
Les régions génomiques transcriptionnellement actives sont denses dans les nucléosomes, ce qui suggère que l'association de l'ADN avec des protéines histones est cruciale pour la régulation négative ou positive de leur transcription..
De même, tout au long de la vie d'une cellule, la réponse à un grand nombre de stimuli, à la fois internes et externes, dépend de petits changements de chromatine, qui ont normalement à voir avec le remodelage et la modification post-traductionnelle des histones trouvées en étroite relation avec ADN.
Plusieurs variables d'histone remplissent différentes fonctions chez les eucaryotes. L'un d'eux concerne la participation d'un variant de l'histone H3 à la formation des structures centromériques responsables de la ségrégation des chromosomes lors de la mitose..
La contrepartie de cette protéine chez d'autres eucaryotes s'est avérée essentielle pour l'assemblage de la protéine kinétochore à laquelle les microtubules du fuseau se lient pendant la mitose et la méiose..
Les références
- Alberts, B., Johnson, A., Lewis, J., Morgan, D., Raff, M., Roberts, K., et Walter, P. (2015). Biologie moléculaire de la cellule (6e éd.). New York: Garland Science.
- Campos, E. I. et Reinberg, D. (2009). Histones: annotation de la chromatine. Annu. Rév. Genet., 43, 559-599.
- Harvey, A. C. et Downs, J. A. (2004). Quelles fonctions fournissent les histones de l'éditeur de liens? Microbiologie moléculaire, 53, 771-775.
- Henikoff, S. et Ahmad, K. (2005). Assemblage d'histones variantes en chromatine. Annu. Rev. Cell. Dev. Biol., vingt-et-un, 133-153.
- Isenberg, I. (1979). Histones. Annu. Rev. Biochem., 48, 159-191.
- Kornberg, R. D. et Thomas, J. O. (1974). Structure de la chromatine: oligomères des histones. La science, 184(4139), 865-868.
- Smith, E., DeLange, R. et Bonner, J. (1970). Chimie et biologie des histones. Examens physiologiques, cinquante(2), 159-170.


Personne n'a encore commenté ce post.