
Isomérie
Qu'est-ce que l'isomérie?
L'isomérie est un phénomène chimique caractérisé en ce que les molécules ayant le même nombre d'atomes ont des propriétés chimiques ou physiques différentes. Ainsi, il se produit dans les isomères, qui à leur tour sont des molécules dont les formules chimiques sont les mêmes, mais leurs structures ou arrangements spatiaux diffèrent sensiblement les uns des autres..
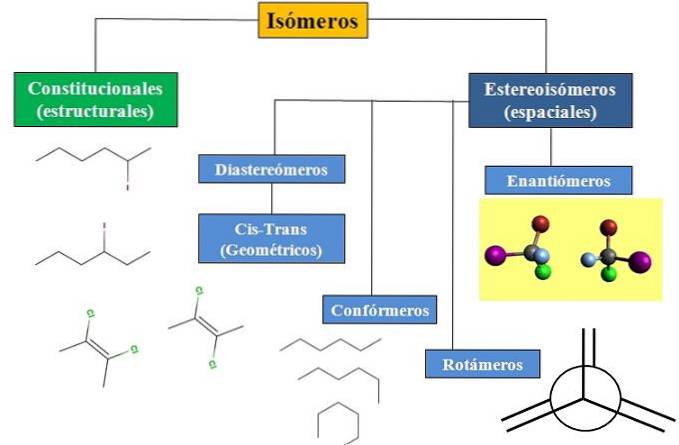
Nous avons une isomérie constitutionnelle ou structurelle et une isomérie spatiale, qui concentre beaucoup d'attention sur la stéréochimie. L'organigramme de l'image ci-dessous montre que les isomères sont principalement divisés en deux types d'isomères qui viennent d'être mentionnés: constitutionnel et stéréoisomères..
Tous les isomères, pour un certain composé, ont la même formule chimique. Mais les structures que ces atomes peuvent construire et leurs proportions sont uniques pour chaque molécule ou isomère. De plus, bien que la structure elle-même soit la même, les atomes ou groupes peuvent occuper différentes positions spatiales..
L'organigramme montre quelques exemples d'isomères qui seront discutés dans les sections suivantes..
Types d'isomères
Constitutionnel
Les isomères constitutionnels ou structuraux sont ceux qui diffèrent dans l'ordre du squelette moléculaire. Autrement dit, leurs atomes ne sont pas liés de la même manière, de sorte que la structure ou les groupes fonctionnels en question peuvent devenir très différents..
Par exemple, pour la même formule chimique C7HdixOu il peut y avoir plusieurs molécules qui rencontrent ce nombre d'atomes; ils auront tous un seul atome d'oxygène, mais la disposition structurelle des autres atomes sera unique pour chaque isomère.
Et donc les propriétés chimiques et physiques de tous les isomères constitutionnels pour la formule C7HdixOu ils seront également très différents les uns des autres.
D'autre part, les isomères constitutionnels peuvent être très simples, ne variant que dans la position relative d'un seul atome ou groupe. Dans la section suivante, vous verrez un exemple de ceci et de ce qui précède dit.
Stéréoisomères
Les stéréoisomères sont ceux qui ont le même ordre structurel, mais qui diffèrent dans les positions et les orientations spatiales de leurs atomes ou groupes..
Pour que leur existence soit possible, les molécules doivent contenir des centres stéréogènes, les plus connus en chimie organique étant des atomes de carbone asymétriques ou chiraux; c'est-à-dire avec quatre substituants différents.
En plus des carbones asymétriques, la molécule considérée doit manquer d'éléments de symétrie. Sinon, il est impossible que l'ordre spatial devienne une stéréoisomérie..
Énantiomères
Les énantiomères sont des stéréoisomères constitués d'images miroir sans chevauchement. Par exemple, les mains droite et gauche ne se chevauchent pas, tout comme les chaussures ou les gants. La section suivante abordera l'exemple classique de l'énantiomérie: le bromochloro dométhane: CBrClI.
Diastéréomères
Les diastéréoisomères, par contre, sont également des stéréoisomères mais ce ne sont pas des images miroir. C'est-à-dire que placés l'un devant l'autre ne sont pas le reflet d'eux-mêmes. Parmi les diastéréoisomères les plus connus, nous avons l'isomérie cis-trans, également appelée isomérie géométrique, en particulier lorsqu'elle est appliquée aux alcènes.
Conformateurs
Les conformères, bien que dans le spectre de la stéréoisomérie, ne sont pas en fait des isomères. Ce sont des configurations spatiales qu'une molécule, à un certain moment ou état énergétique, acquiert par les rotations de plusieurs de ses liaisons. Nous verrons dans la section suivante l'exemple des conformères du n-hexane.
Rotamères
Enfin, nous avons des rotamères, qui ressemblent à des conformères en ce sens qu'ils dépendent de la rotation des liaisons covalentes..
Cependant, une simple liaison entre deux atomes de carbone est prise comme référence, et les positions relatives, qu'elles soient éclipsées ou alternées, des substituants pour les deux atomes de carbone sont comparées. Plus tard, nous verrons l'exemple des rotamères de propylène.
Exemples d'isomères
Hexane iode
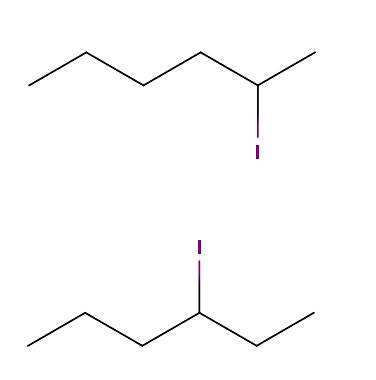
Ci-dessus, nous avons deux molécules dont les formules chimiques sont C6H13I. Dans le premier, nous avons le 2-iodohexane, tandis que dans le second, le 3-iodohexane. Ce sont des isomères constitutionnels de type positionnel, puisque le squelette est le même, à la différence que la position de l'atome d'iode varie d'un carbone à l'autre..
C3H8OU ALORS
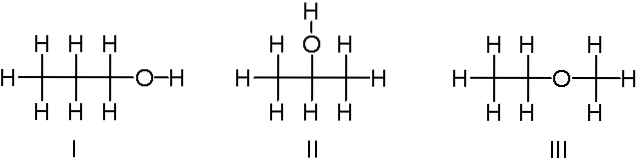
Ci-dessus, nous avons un autre exemple d'isomères constitutionnels pour la formule chimique C3H8O. Les molécules I et II sont respectivement le 1-propanol et le 2-propanol. Ce sont tous les deux des alcools. Au lieu de cela, la molécule III concerne l'éthyl-méthyl-éther.
Par conséquent, nous parlons d'un autre groupe fonctionnel. Notez que les trois molécules ont le même nombre d'atomes, mais leurs structures sont différentes..
2,3-dichloro-2-butène
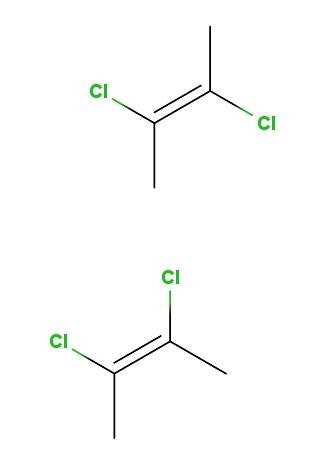
Au-dessus, nous avons l'isomère trans-2,3-dichloro-2-butène, et en dessous, nous avons l'isomère cis-2,3-dichloro-2-butène. Dans le premier, les atomes de chlore sont dans des positions opposées par rapport à la double liaison, tandis que dans le second, ils se trouvent du même côté de la double liaison..
Le squelette des deux molécules est le même, mais ils diffèrent dans les positions spatiales des atomes de chlore; par conséquent, ce sont des stéréoisomères, et comme ce ne sont pas des images miroir, ils deviennent des diastéréoisomères.
3-fluor-2-méthylcyclohexane
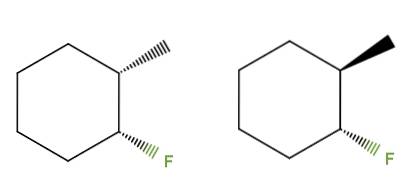
Cette fois, au lieu d'une double liaison, nous avons un cycle cyclohexane pour le composé 3-fluoro-2-méthylcyclohexane. Dans l'isomère gauche, les groupes CH3 et F sont au-dessous du plan de l'anneau; tandis que dans celui de droite, le CH3 est en haut et le F est en bas.
Par conséquent, celui de gauche correspondrait à l'isomère cis, et celui de droite serait l'isomère trans. Ce sont donc des diastéréoisomères, car là encore ce ne sont pas des images miroir.
Conformes de n-hexane
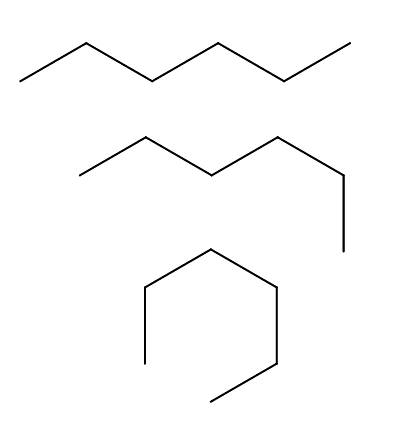
Nous avons au-dessus de trois conformères de la n-l'hexane, qui résultent des rotations et des «courbures» de la chaîne carbonée dans différentes orientations. Ils correspondent tous à la même molécule de n-hexane avec différents niveaux de pliage, qui dépendra de l'environnement et de l'énergie interne de chaque molécule.
3-bromo-2-pentanol
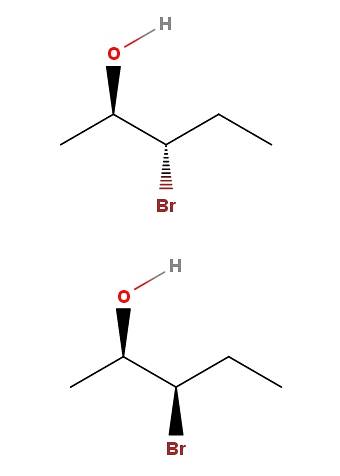
Dans le 3-bromo-2-pentanol, nous avons un autre exemple d'une paire de diastéréomères. Notez qu'une fois de plus, dans l'isomère ci-dessus, nous avons OH et Br pointant dans les directions opposées du plan du squelette; tandis que dans l'isomère inférieur, les deux groupes pointent vers la direction du lecteur.
1-bromo-3-chloro-5-éthylcyclohexane
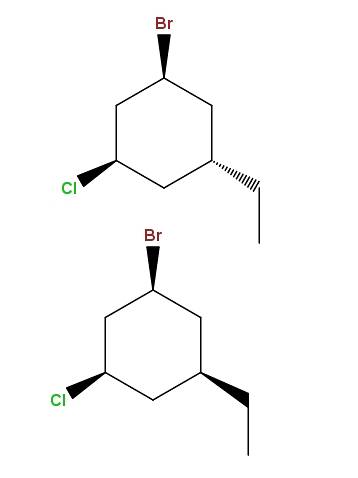
Et encore une fois, nous avons une autre paire de diastéréomères, à la différence que maintenant la différence réside dans la position spatiale d'un seul groupe: l'éthyle, -CHdeuxCH3.
Ce type d'isomères a un nom très spécifique: les épimères, qui sont des diastéréoisomères dont la variation n'est observée que dans la configuration spatiale d'un seul carbone asymétrique; dans ce cas, celui lié au -CHdeuxCH3.
Bromochlorooyodométhane
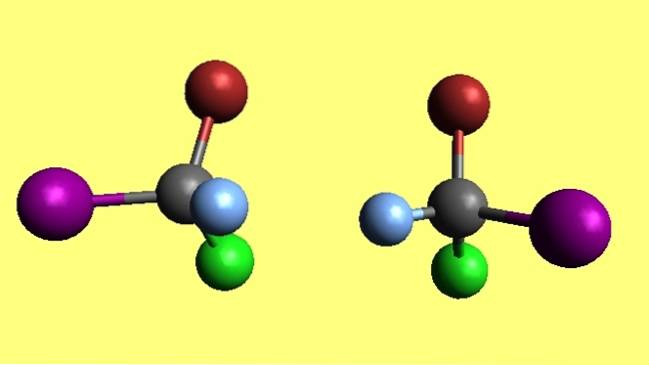
A noter que les deux molécules de bromochloroiodométhane, CBrClI, sont des énantiomères car l'une est le reflet non superposable de l'autre. Peu importe vos efforts, ses quatre atomes ne correspondront jamais. On dit qu'ils possèdent des configurations spatiales opposées.
2-bromo-4-éthylcyclohexane
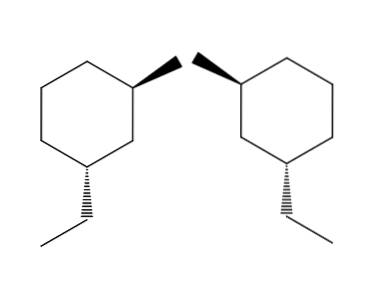
Dans l'exemple du couple de molécules 2-bromo-4-éthylcyclohexane, l'énantiomérie est encore plus évidente. Si nous essayons de retourner la molécule à droite, nous verrons que le groupe -CHdeuxCH3 il ne sera pas situé sous l'anneau mais au-dessus.
De même, le CH3 Il ne pointera pas vers le haut du ring mais en dessous. Les configurations spatiales sont inversées, elles sont opposées. C'est une autre des caractéristiques les plus importantes de l'énatiomérie..
Rotamères de propylène
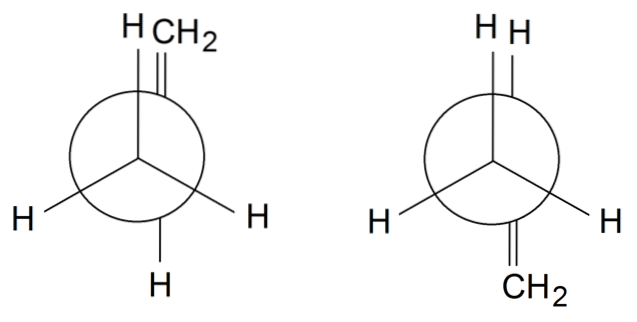
Dans les rotamères de propylène, pour finir, on fait tourner la liaison simple entre C1 et Cdeux: H3C-CH = CHdeux. Le groupe = CHdeux est dans une position éclipsée avec l'un des H du groupe CH3 avant sur le rotamètre à gauche. Pendant ce temps, le = CHdeux et H sont dans des positions alternées sur le rotamère droit.
Selon l'éclipse ou non des groupes, nous aurons un encombrement stérique, qui déstabilisera le rotamère. Par conséquent, le rotamère de droite est plus stable que celui de gauche..
Les références
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. (dixe édition.). Wiley plus.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Morrison et Boyd. (1987). Chimie organique. (Cinquième édition). Addison-Wesley Iberoamericana.
- Dr S. Gevorg. (2020). Énantiomères, diastéréoisomères, isomères identiques ou constitutionnels. Étapes de chimie. Récupéré de: chemistrysteps.com
- Wikipédia. (2020). Isomère. Récupéré de: en.wikipedia.org
- Allison Soult. (13 août 2020). Isomères. Chimie LibreTexts. Récupéré de: chem.libretexts.org
- James Ashenhurst. (2020). Stéréochimie et chiralité. Récupéré de: masterorganicchemistry.com


Personne n'a encore commenté ce post.